Катализатор — это… Что такое Катализатор?
Схема протекания реакции с катализаторомКатализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания.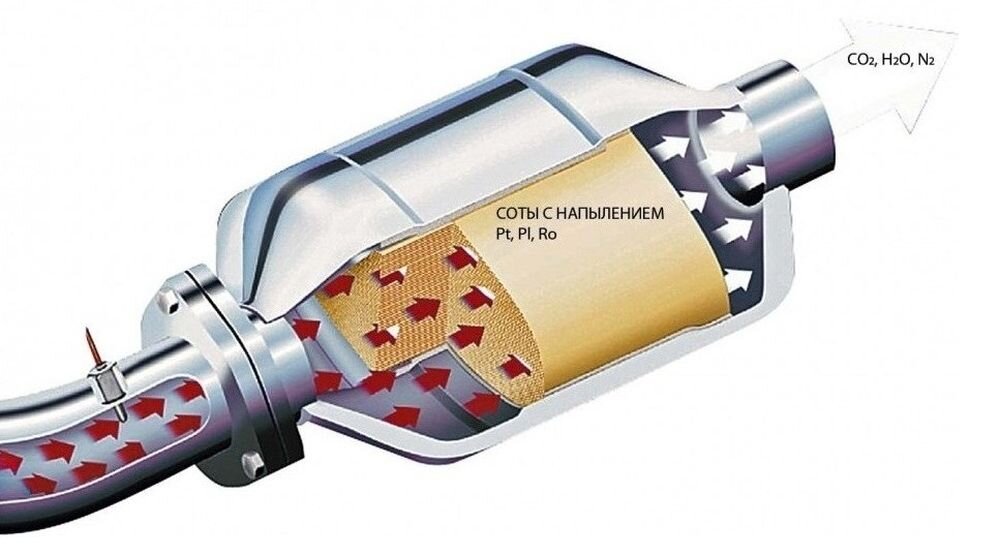
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO 3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
 [4]
[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
Ссылки
Что такое катализатор и какие функции он выполняет
Выхлопные газы
Андрей Квитка, 06 ноября 2015, 12:42Большинство автовладельцев начинают интересоваться такой деталью, как нейтрализатор, только после того, как он выходит из строя, и о его замене или ремонте сообщают в автосервисе. Это и не мудрено, так как деталь эта довольно сложная и находится в таком месте, куда автовладельцы заглядывают редко. Будучи частью выхлопной системы, катализатор расположен внизу автомобиля.
Это и не мудрено, так как деталь эта довольно сложная и находится в таком месте, куда автовладельцы заглядывают редко. Будучи частью выхлопной системы, катализатор расположен внизу автомобиля.
Так что же все-таки представляет собой данная деталь, которую еще называют «каталитический нейтрализатор». Исходя из этого названия, можно сделать вывод, что катализатор предназначен для нейтрализации чего-либо. Так и есть, данная деталь позволяет снизить (нейтрализовать) вредные химические соединения, которые продуцируются в процессе сгорания рабочей смеси в двигателе.
Проще говоря, катализатор убирает часть вредных выбросов, содержащихся в выхлопных газах автомобиля. Он является основной частью системы, позволяющей автопроизводителям укладываться во все ужесточаемые экологические нормы. Если раньше машин, не оборудованных катализатором, выпускалось немало, то сейчас практически в каждом новом авто есть данная деталь той или иной сложности и эффективности.
Внутри катализатор имеет сотовую металлическую конструкцию, с нанесенным на ней тонким слоем платино-иридиевого сплава.
Большинство катализаторов рассчитаны на 100 тыс. км пробега автомобиля, однако существенно уменьшить срок «жизни» данной детали могут такие факторы, как низкое качество топлива и неправильная регулировка системы смесеобразования. В этих случаях соты попросту забиваются и перестают вступать в реакцию с выхлопными газами. В итоге значение вредных выбросов достигает определенного предела, после чего специальные датчики фиксирую превышение и передают на блок электронного управления автомобиля сообщение об ошибке, которое высвечивается на приборной панели в виде предупреждения «Check Engine».
Что же делать, если катализатор вышел из строя? Можно заменить его на новый оригинальный, можно поставить универсальные катализатор, а можно и вовсе убрать его из системы, поставив вместо него пламегаситель.
Самый дорогой вариант – поставить оригинал. Оптимальный вариант – установка универсального катализатора. Кроме того, можно вообще уделить его из выхлопной системы, установив взамен пламегаситель, который не снизит выбросы вредных веществ, но позволит выпускной системе нормально работать и без катализатора.
Зачем нужен старый катализатор в авто и можно ли его удалить? | Обслуживание | Авто
Автомобили возрастом свыше 15 лет, которые проездили в России более 150 тысяч пробега, всегда имеют проблемы с системой выхлопа. Владельцы, наслушавшись разговоров об опасности старого катализатора в выхлопной системе, спешат его демонтировать. Причем вместе с катализатором они меняют и систему контроллеров с датчиком кислорода или перепрошивают двигатель под более низкие экологические стандарты. Допустима ли такая самодеятельность и как отсутствие катализатора может повлиять на функционирование мотора?
Принцип действия очистителя выхлопа
Самым токсичным газом в выхлопе автомобиля считается угарный газ, а также оксиды азота, являющиеся продуктом неполного сгорания углеводородного топлива. В 1970 году к иностранным производителям было предъявлено требование оснастить все машины нейтрализатором отработанных газов, который дожигал их в специальной термической камере. С 1975 года установка катализаторов стала обязательным требованием к производителям автомобилей за рубежом.
В 1970 году к иностранным производителям было предъявлено требование оснастить все машины нейтрализатором отработанных газов, который дожигал их в специальной термической камере. С 1975 года установка катализаторов стала обязательным требованием к производителям автомобилей за рубежом.
Катализатор, несмотря на свою надежность, имеет сроки службы и выходит из строя через 10-15 лет эксплуатации. Его ресурс также снижается из-за физических повреждений или по причине оплавления и спекания ячеек, в результате использования некачественного топлива или банально из-за неисправностей системы зажигания. В результате нарушается проходимость газов, снижается отдача мотора, наблюдается потеря динамики. В общем, требуется замена нейтрализатора.
Удаление нейтрализатора и перепрошивка ЭБУ
Отечественные мастера для 10-летних или 15-летних машин рекомендуют другой порядок «ремонта». Они удаляют банку целиком и вваривают вместо нее трубы выхлопной системы.
Они удаляют банку целиком и вваривают вместо нее трубы выхлопной системы.
Этот шаг влечет за собой массу побочных эффектов. При отсутствии каталитического нейтрализатора программы управления двигателем начинают сбоить. Они опрашивают датчики, в том числе лямбда-зонд, измеряющий количество кислорода в выхлопе. Ориентируясь на полученные данные, электронный блок управления «решает», сколько впрыскивать топлива в цилиндры через форсунки. Однако если прибор утрачен, то нужная информация отсутствует, и система переходит в аварийный режим, снижает тягу и готовит усредненную смесь. Характеристики мотора резко падают.
Мастера советуют в этом случае перепрошить электронный блок управления и перевести его на Евро 2. В этом случае работа впрыска тоже будет подведена к какому-то усредненному значению, искажающему изначальные характеристики мотора. График его работы видоизменяется, мощность падает, снижается планка крутящего момента.
В общем, после удаления каталитического нейтрализатора мотор уже не станет выдавать прежних характеристик. Кроме того, усредненная смесь будет сгорать в цилиндрах не полностью, начнется выпадение смол, закоксовывание мотора, и проявятся прочие вредные явления, постепенно разрушающие силовой агрегат.
Кроме того, усредненная смесь будет сгорать в цилиндрах не полностью, начнется выпадение смол, закоксовывание мотора, и проявятся прочие вредные явления, постепенно разрушающие силовой агрегат.
Токсичный выхлоп
Есть и другой способ — установить в систему выхлопа обманку. Датчик кислорода устанавливается в специальную проставку так, чтобы в него попадало как можно большей кислорода из атмосферы. В результате менять ПО не требуется, поскольку система продолжает работать в штатном режиме. Но есть у метода и свои недостатки. ЭБУ, пользуясь неверными данными, не сможет правильно корректировать приготовление горючей смеси и перестанет регулировать угол опережения зажигания, в результате чего вредное воздействие на двигатель продолжится.
Кроме того, машина без катализатора выбрасывает в атмосферу больше вредных веществ, ее выхлоп неприятно пахнет, газы проникают в салон, раздражают при холодном запуске и отравляют воздух при длительном прогревании машины зимой.
В общем, лучше не экономить на выхлопной системе и произвести полноценный ремонт, установив вместо старого запекшегося каталитического нейтрализатора новый. Тогда автомобиль продолжит радовать отменной динамикой, и водителю не придется вдыхать его ядовитые газы.
Тогда автомобиль продолжит радовать отменной динамикой, и водителю не придется вдыхать его ядовитые газы.
Что такое катализатор в автомобиле? Устройство и принцип работы
Сегодня в этой статье мы рассмотрим более подробно узнаем, что такое катализатор в выхлопной системе и зачем его устанавливают на автомобиль.Автомобильный катализатор — это устройство, которое в качестве отдельного элемента входит в состав системы выпуска отработавших газов и играет роль барьера, препятствующего выбросу в воздушную атмосферу губительных для экологии продуктов топливного сгорания. Его еще называют каталитическим нейтрализатором.
Элемент этот с недавних пор вводится в конструкцию всех типов двигателей внутреннего сгорания: бензиновых и дизельных, а устанавливается чаще всего сразу за коллектором выпуска или впереди глушителя.
Конструкция катализатора
В устройстве каталитического нейтрализатора различаются следующие конструктивные элементы:
• Блок-носитель;
• Корпус;
• Теплоизоляция.
Главный компонент каждого устройства нейтрализации отработавших газов – блок-носитель, именно он является его основой. Выполняется блок-носитель чаще всего из термостойкой керамической массы. Однако, автомобильный катализатор может производиться и из металла (намного реже).
В связи с необходимостью достижения максимально большой рабочей площади соприкосновения с газами, при сохранении внешних компактных размеров, катализационный блок-носитель выполняется в виде мелкоячеистых сот. Они имеют либо прямоугольную форму, либо форму шести- или восьмиугольника.
Чтобы защитить блок-носитель от разрушения, он помещается чаще всего в стальной корпус. Между стенками которого и блоком помещается прослойка из термоизолирующего материала. Также в корпус нейтрализатора встраивается кислородный датчик.
Активные вещества каталитического нейтрализатора
Поверхность сот подлежит специфической обработке, в процессе которой на нее наносятся активные вещества, обладающие в отношении вредных примесей выхлопа двигателя каталитическим эффектом. В качестве таких веществ используются благородные металлы платиновой группы: платина, палладий и родий. Именно они оказывают влияние на скорость течения химических реакций, происходящих в нейтрализаторе.
В качестве таких веществ используются благородные металлы платиновой группы: платина, палладий и родий. Именно они оказывают влияние на скорость течения химических реакций, происходящих в нейтрализаторе.
При этом к категории окислительных катализаторов относятся палладий и платина. Благодаря своим химическим свойствам, они существенно ускоряют процесс окисления до водяного пара углеводородов (CH), которые не догорели, а образующегося при горении угарного газа (CO) в углекислый газ (CO2).
Вместе с тем родий – катализатор восстановительный, его роль заключается в восстановлении вредных окислов азота (NOx) до безвредного для природы азота, объемное содержание которого в атмосфере составляет порядка 78,08%.
Как становится понятным, катализатор на автомобиле используется для удаления из выхлопа трех самых вредных примесей, образующихся при горении любого вида жидкого топлива. В связи с таким своим предназначением он носит название трехкомпонентного каталитического нейтрализатора. Для того, чтобы он эффективно работал, необходимо поддержание его в рабочем состоянии с температурой в 300оC.
Для того, чтобы он эффективно работал, необходимо поддержание его в рабочем состоянии с температурой в 300оC.
Именно при таком разогреве рабочих поверхностей сот автомобильного катализатора достигается удаление из выхлопа практически 90% из объема проходящих сквозь него вредных газовых примесей. Чтобы гарантировать эффективный и быстрый прогрев каталитического нейтрализатора до уровня рабочих температур при пуске холодного мотора, находят применение следующие меры:
• Нейтрализатор монтируется прямо вслед за коллектором выпуска отработавших газов;
• чтобы увеличить температуру выхлопа, блок управления работой двигателя на некоторое время увеличивает подачу топлива, делая рабочую воздушно-топливную смесь обогащенной.
Помимо керамических нейтрализаторов, которые нашли самое широкое распространение, используются и иные конструкции и решения. Такие катализаторы делают возможным снижение содержания вредных примесей в отработавших газах.
Магнитно-стрикционные катализаторы (МСК)
Данный тип катализатора является самым продвинутым и ультрасовременным, несмотря на более чем сорокалетнюю историю самой технологии. По сути это – автомобильная технология теперь уже ближайшего автомобильного грядущего.
По сути это – автомобильная технология теперь уже ближайшего автомобильного грядущего.
Эксперименты в направлении разработки методики были развернуты в прошлом веке, еще в 70-х годах. Однако из-за невозможности стабилизировать процесс обработки топлива, работы были приостановлены до лучших времен. А то, что было достигнуто, не пошло в серийную практику.
Сущность технологии катализатора (МСК) лежит в магнитно-стрикционном улучшении атомов углерода. Они являются частью молекул углеводородов, то есть горюче-смазочных материалов.
В результате обработки происходит модификация взаимосвязей топливных углеводородных цепочек и сохранение состояния топлива в достигнутом положении до его полного сгорания.
Катализатору в автомобиле отводится большая роль. Устройство гарантирует подготовку топлива еще до его воспламенения. В итоге, он оказывает влияние на скорость сгорания обработанного топлива. Возрастание скорости горения обеспечивает более качественное сгорание.
За счет этого возрастает коэффициент полезного действия двигателя, снижается нагарообразование, улучшается качество выхлопа со значительным снижением в нем вредных примесей. Создаются благоприятные условия по предохранению от преждевременного износа кривошипно-шатунного механизма мотора.
Создаются благоприятные условия по предохранению от преждевременного износа кривошипно-шатунного механизма мотора.
Поделитесь информацией с друзьями:
Что такое катализатор в автомобиле? — виды и принцип действия | Моторное масло — ГСМ
Решение экологических вопросов в последнее время становится все более актуальным. Это связано не столько с усугублением возникающих проблем охраны окружающей среды, сколько с требованиями, которые диктуют специальные организации ЕС.
Одним из аспектов деятельности экологических организаций является контроль над токсичностью отработавших газов автомобилей. Эта проблема актуальна не только в Европе, но и в странах СНГ.
Методом минимизации токсичности выхлопных газов является применение на автомобилях устройств, именуемых катализаторами. Они призваны получить выхлопы с определенным содержанием СО, СН, NO, не превышающим установленных ЕС норм.
В настоящее время катализаторы можно подразделить на три вида: керамический катализатор, химический катализатор, магнитно-стрикционный катализатор.
Рассмотрим каждый из них с выделением некоторых характеристик.
Керамический катализатор в машине
Керамический катализатор дожигания (ККД) представляет собой керамическую сотовую конструкцию. Соты необходимы для того, чтобы увеличить площадь контакта выхлопных газов с поверхностью, на которую нанесен тонкий слой платиноиридиевого сплава. В состав данного напыления входят такие дорогие металлы как платина, палладий и радий. Недогоревшие остатки (CO, CH, NO), касаясь поверхности каталитического слоя, окисляются кислородом, присутствующим в выхлопных газах. В результате реакции выделяется тепло, разогревающее катализатор, и активизируется реакция окисления. В конечном итоге выхлопные газы имеют необходимую концентрацию СО2. Именно углекислый газ на выходе является следствием наличия катализатора в выхлопной системе.
Большинство иномарок сейчас комплектуются керамическими катализаторами дожигания сразу при сборке. Для завезенных ранее на территорию России бывших в употреблении автомобилей, а также для произведенных на территории СНГ можно приобрести импортные или отечественные ККД. Из поставляемых в страны СНГ катализаторов наиболее распространены устройства фирмы «Bosal».
Из поставляемых в страны СНГ катализаторов наиболее распространены устройства фирмы «Bosal».
Однако наличие прибора данного типа при эксплуатации машины в России доставляет автовладельцу много проблем. Это можно объяснить несколькими факторами.
Во-первых, к нам в страну далеко не всегда прибывают только новые иномарки с минимальным пробегом. Срок же службы катализатора при правильной эксплуатации (имеется в виду использование качественных нефтепродуктов) сопоставим с 100-120 тыс. км пробега автомобиля, после чего рекомендуется замена ККД, что вполне естественно. Катализатор имеет фильтрующие свойства, а фильтры, как известно, нужно менять. Дальнейшее использование устройства вполне допустимо, что и делается у нас, однако нужно четко представлять, что в таком случае в выхлопной системе присутствует элемент далеко не со стопроцентной пропускной способностью. К этому сроку на стенках сот уже осела сажа и продукты недогоревшего масла, которые существенно препятствуют выходу выхлопных газов.
Во-вторых, заправляетесь вы на наших российских заправках. Не секрет, что до сих пор качество бензина на некоторых АЗС не вполне удовлетворительное, а ведь одним из основополагающих условий нормальной работы катализатора является качественный бензин. Для керамических сот с напылением некачественное топливо смертельно. Ведь в результате его попадания в устройство, соты оплавляются, залипают, и проходимость выхлопных газов практически прекращается. По сути, происходит то же самое, что и при забивании сот сажей и продуктами недогоревшего масла, только гораздо быстрее. Таким образом, некачественный бензин — основная опасность для катализатора.
Очень обидно бывает за владельцев автомобилей, которые даже не наездили 70-80 тыс. км, а катализаторы в их машинах уже испорчены. Естественно, у человека не возникает никакого желания покупать новые дорогостоящие детали, не имея никакой уверенности в том, что, поставив их и покатавшись непродолжительное время, он не столкнется с необходимостью повторной замены.
К третьей проблеме использования керамического катализатора дожигания по праву нужно отнести отечественные дороги. Как ни крути, а керамические соты — достаточно хрупкий материал, который при сильном ударе может треснуть и расколоться. В результате удара соты отходят от стенок прибора, начинают дребезжать и перемещаться внутри корпуса, из-за чего окончательно рассыпаются, разлетаясь по всей выхлопной системе.
Если в катализаторе накопился бензин, то машина долго не заводится. И когда, наконец, двигатель удалось запустить, внутри происходит мини-взрыв, который приводит к разрушению керамического катализатора дожигания. По этой причине нельзя, чтобы автомобиль «подъедал» масло.
Что касается неисправностей ККД, то их существует две разновидности. Первая состоит в том, что от времени катализатор «забивается» и у него уменьшается пропускная способность выхлопных газов. Признаком этого является ощущение того, что машина не «тянет», происходит ухудшение динамики разгона и снижение мощности автомобиля, иногда плавает стрелка оборотов на холостом ходу. Вторая — более критичная. Она проявляется в том, что катализатор уже разрушился, и вас беспокоит звук, дребезжание рассыпавшихся керамических сот или гудение «пустой бочки».
Вторая — более критичная. Она проявляется в том, что катализатор уже разрушился, и вас беспокоит звук, дребезжание рассыпавшихся керамических сот или гудение «пустой бочки».
Недостатками катализаторов дожигания являются снижение оборотов и мощности двигателя, увеличение расхода топлива на 15 %. Чтобы избежать этого, некоторые автовладельцы «пробивают» блок ККД насквозь, а показания токсичности опять превышают норму.
Химический автомобильный катализатор
Второй тип катализаторов — химические, попросту говоря, присадки. Их сейчас существует бесчисленное количество разных марок, и призваны они улучшить некоторые эксплуатационные свойства топлив, масел, увеличить износостойкость узлов и агрегатов автомобилей. Разработанные присадки для улучшения процесса сгорания топлива (анамегаторы топлива) изменяют его химический состав, повышают полноту сгорания, снижают явление детонации и токсичность выхлопов.
Детонационное сгорание проходит две стадии. На первой происходит предпламенное (холоднопламенное) окисление, во время которого в рабочей смеси образуется значительная часть перекисей в процессе впуска в камеру сгорания топлива от соприкосновения с нагретыми деталями. На второй — горячий взрыв (видимое горение). После воспламенения рабочей смеси образование перекисей происходит более интенсивно; они концентрируются в ее несгоревшей части, суммируясь с образовавшимися на первом этапе, и по достижении критической концентрации распадаются со взрывом и выделением большого количества тепла.
На второй — горячий взрыв (видимое горение). После воспламенения рабочей смеси образование перекисей происходит более интенсивно; они концентрируются в ее несгоревшей части, суммируясь с образовавшимися на первом этапе, и по достижении критической концентрации распадаются со взрывом и выделением большого количества тепла.
Для нормального горения бензина концентрация перекисных соединений не должна превышать определенных показателей. Анамегатор, как и ТЭС, препятствует образованию гидропероксидов. Тетраэтилсвинец работает как антидетонатор только на первой стадии детонационного горения.
Введение этиловой жидкости приводит к повышению токсичности выхлопа, снижению мощности двигателя (повышению расхода топлива), увеличивает нагароотложения и, следовательно, количество абразива в цилиндро-поршневой группе.
Анамегатор ориентирует молекулы углеводорода таким образом, что они гораздо легче входят в реакцию окисления. В результате горение происходит с большей энергоотдачей, повышается мощность двигателя (снижается расход топлива), создаются препятствия нагарообразованию, из камеры сгорания удаляются продукты распада тетраэтилсвинца.
Антидетонационное действие анамегатора и тетраэтилсвинца суммируются. Повышение мощности происходит за счет более полного сгорания углеводородов топлива. Это снижает количество несгоревших продуктов в выхлопных газах, которые являются источником токсичности.
Мощность и расход топлива — две связанные между собой величины. Если вы на своем автомобиле до применения анамегаторов ездили со скоростью, скажем, 70 км/ч, а после применения, почувствовав прибавку мощности, стали ездить быстрее, то экономии вы можете не обнаружить. Сэкономленное топливо, образно говоря, «ушло» на повышение скорости движения, то есть на выполнение дополнительной работы. Но если скорость и другие факторы останутся неизменными, то экономия будет очевидной.
Действие анамегаторов в топливе изменяется в зависимости от их концентрации. Если в бензине необходимо предотвращать образование гидропероксидов для обеспечения детонационной стойкости, то в дизельном топливе их наличие повышает способность к самовоспламенению. Неодинаковая концентрация по-разному ориентирует молекулы углеводородов, придавая им различные свойства. Поэтому очень важно соблюдать рекомендованные пропорции.
Неодинаковая концентрация по-разному ориентирует молекулы углеводородов, придавая им различные свойства. Поэтому очень важно соблюдать рекомендованные пропорции.
Во фракционном составе дизельного топлива углеводороды более тяжелые, чем у бензина. Энергоотдача такого топлива выше. Поскольку анамегаторы высвобождают энергию из изначально заложенного большего количества сконцентрированной энергии, то и отдача их будет выше.
К недостаткам химического катализатора можно отнести, в первую очередь, постоянную необходимость его замены. К тому же при неправильной концентрации анамегатора с топливом может возникать коррозия металла топливного бака и других агрегатов. По той же причине может возрасти расход топлива до 10 %. Наиболее усовершенствованные анамегаторы — Т-4, Т-6.
Магнито-стрикционный (МСК) катализатор
Третий тип катализаторов — магнито-стрикционные (МСК), которые в настоящее время являются самыми современными и лежат в основе автотехнологии будущего. Самому этому методу уже около 40 лет. Экспериментальные разработки велись еще в 70-х годах, но не нашли широкого применения из-за несовершенства стабилизации процесса. Суть метода заключается в магнитно-стрикционной обработке молекулы углерода, присутствующей в любом ГСМ. При этом химический состав топлива не изменяется, а меняются только его физические свойства. «Правильно» сориентированная молекула способна свободной парой присоединить большее количество кислорода, что, естественно, отражается на полноте и теплоемкости горения. Сам катализатор представляет собой устройство предварительной обработки топлива. Он устанавливается в топливную систему автомобиля в зависимости от вида топлива. На бензиновые, карбюраторные и инжекторные двигатели МСК устанавливают перед карбюратором (инжектором), просто отсоединив топливный шланг и вставив устройство между ними. На дизельные автомобили, у которых объем цилиндров превышает 1 800 см3, прибор рекомендуется устанавливать перед каждой форсункой плюс еще один перед насосом высокого давления (НВД).
Самому этому методу уже около 40 лет. Экспериментальные разработки велись еще в 70-х годах, но не нашли широкого применения из-за несовершенства стабилизации процесса. Суть метода заключается в магнитно-стрикционной обработке молекулы углерода, присутствующей в любом ГСМ. При этом химический состав топлива не изменяется, а меняются только его физические свойства. «Правильно» сориентированная молекула способна свободной парой присоединить большее количество кислорода, что, естественно, отражается на полноте и теплоемкости горения. Сам катализатор представляет собой устройство предварительной обработки топлива. Он устанавливается в топливную систему автомобиля в зависимости от вида топлива. На бензиновые, карбюраторные и инжекторные двигатели МСК устанавливают перед карбюратором (инжектором), просто отсоединив топливный шланг и вставив устройство между ними. На дизельные автомобили, у которых объем цилиндров превышает 1 800 см3, прибор рекомендуется устанавливать перед каждой форсункой плюс еще один перед насосом высокого давления (НВД).
За счет наиболее полного сгорания смеси в двигателе его мощность увеличивается, следствием чего является снижение расхода топлива. Экологические показатели при этом улучшаются в 3-4 раза. Также уменьшаются нагароотложения на рабочих поверхностях двигателя, что приводит к существенному продлению срока его эксплуатации, более бесшумной и бездетонационной работе (что ощущается сразу после установки), повышению пробега между заменой масла.
Установка данных катализаторов занимает от 5 до 20 минут. Предварительно проводится диагностика топливной системы. У карбюраторных двигателей корректируется зажигание, у инжекторных — лямбда-зоны, а у дизельных — винт холостых оборотов.
Магнито-стрикционные автомобильные катализаторы производятся во многих странах: Венгрии, Польше, Китае, Великобритании, России и др.
Автомобильный катализатор и его роль в выхлопной системе
Катализатор имеет удивительно простое устройство, но воздействие его очень велико. Из этой статьи вы узнаете, какие загрязняющие вещества образуются в результате работы двигателя, и как каталитический преобразователь справляется с каждым из них, сокращая выбросы вредных выхлопных газов.
Автомобильные катализаторы
На дороги ежедневно выезжают миллионы автомобилей, и каждый из них — источник загрязнения воздуха. Особенно это чувствуется в крупных городах, где выхлопные газы автомобилей могут создавать большие проблемы.
Каталитический преобразователь или катализаторДля решения этих проблем каждая страна издает свои законы, которые ограничивают допустимый уровень загрязнения, который может создавать каждая машина. За прошедшее время автопроизводители внесли много улучшений в конструкцию автомобильного двигателя и топливных систем, чтобы соответствовать этим требованиям. Одно из значительных изменений произошло в 1975 году — именно в этом году появилось новое устройство, называемое каталитическим преобразователем (конвертером) или просто катализатором. Работа каталитического преобразователя заключается в преобразовании вредных выхлопных газов в менее вредные прежде, чем они покинут выхлопную систему автомобиля.
Выбросы загрязняющих веществ
В целях сокращения выбросов, современные автомобильные двигатели тщательно контролируют количество сжигаемого ими топлива. Их задача — сохранить соотношение «воздух-топливо» как можно ближе к идеальной точке, называемой стехиометрической. Теоретически, при этом соотношении все топливо сгорит с использованием всего имеющегося в воздухе кислорода. Для бензина стоихиометрический коэффициент — около 14,7:1, что значит, что при сожжении одной единицы бензина будет сожжено 17,4 единицы воздуха. фактически во время езды сгорание топливной смеси немного отличается от идеального соотношения. Иногда смесь может быть бедной (при коэффициенте «воздух-топливо» выше, чем 14,7), или, наоборот, насыщенной (при более низком коэффициенте).
Их задача — сохранить соотношение «воздух-топливо» как можно ближе к идеальной точке, называемой стехиометрической. Теоретически, при этом соотношении все топливо сгорит с использованием всего имеющегося в воздухе кислорода. Для бензина стоихиометрический коэффициент — около 14,7:1, что значит, что при сожжении одной единицы бензина будет сожжено 17,4 единицы воздуха. фактически во время езды сгорание топливной смеси немного отличается от идеального соотношения. Иногда смесь может быть бедной (при коэффициенте «воздух-топливо» выше, чем 14,7), или, наоборот, насыщенной (при более низком коэффициенте).
Основные загрязняющие вещества, вырабатываемые двигателем, это:
- газообразный азот (N2) — воздух состоит на 78 процентов из газообразного азота, и большая часть его проходит сквозь автомобильный двигатель
- диоксид углерода (СО2) — один из продуктов сгорания. Углерод из топлива соединяется с кислородом воздуха.
- водяной пар (H2O) — еще один продукт сгорания.
 Водород из топлива соединяется с кислородом воздуха.
Водород из топлива соединяется с кислородом воздуха.
Это выбросы в основе своей не опасны, хотя, как считается, выброс углекислого газа (СО2) способствует глобальному потеплению. Но так как процесс горения никогда не совершенен, небольшое количество гораздо более вредных выхлопных газов выделяется при работе двигателя автомобиля. Именно на снижение их уровня ориентированы каталитические преобразователи:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счет неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
В следующем разделе мы рассмотрим, какие именно процессы происходят внутри каталитического преобразователя.
Как катализаторы сокращают вредные выбросы в выхлопных газах
Если вспомнить химию, то катализатор — это вещество, которое ускоряет или вызывает химическую реакцию, само не входя в продукты реакции. Катализаторы участвуют в реакции, но не являются не реактивом, ни продуктом реакции. Так, для человеческого организма естественным катализатором многих важных биохимических реакций являются ферменты.
В каталитических преобразователях существуют два различных типа катализаторов: восстанавливающий катализатор и окислительный катализатор. Оба типа состоят из керамической структуры, покрытой металлическим катализатором (обычно это платина, родий и/или палладий). Идея заключается в том, чтобы создать структуру, которая подставляет под поток выхлопных газов максимальную площадь катализатора и свести к минимуму задействованное при этом количество самого катализатора, так как используемые материалы весьма дороги. В некоторых преобразователях даже стали использовать золото с примесью более традиционных катализаторов. Золото дешевле по сравнению с остальными катализаторами, и может повысить степень окисления на 40 процентов, что необходимо для снижения количества вредных газов.
Золото дешевле по сравнению с остальными катализаторами, и может повысить степень окисления на 40 процентов, что необходимо для снижения количества вредных газов.
Большинство современных выхлопных систем в автомобилях оснащены тремя каталитическими преобразователями, по одному для каждого из веществ, выброс которых необходимо уменьшить.
Восстанавливающий катализатор — первый этап каталитического преобразователя. Он использует платину и родий чтобы уменьшить выбросы NOx. Когда молекула NO или NO2 встречается с молекулами катализатора, от нее отделяется атом азота, высвобождая кислород — O2. Атом азота же связывается с другим атомом азота, образуя N2.
Окислительный катализатор — второй этап каталитического преобразователя. Он снижает количество несгоревшего топлива и окиси углерода в результате их сжигания (окисления) с помощью таких катализаторов, как платина и палладий. Этот катализатор также помогает СО вступить в реакцию с несгоревшим кислородом, образуя углекислый газ СО2.
Существуют два основных вида конструкций, используемых в каталитическом преобразователе — это конструкция по типу «соты» и «керамические бусины». Большинство автомобилей используют сотовые структуры.
Следующий раздел посвещен третьей стадии процесса преобразования, и тому, как добиться от своего каталитического преобразователя лучшего результата.
Контроль загрязнения и повышение эффективности выхлопной системы
Третьим этапом преобразования является система управления, которая контролирует поток выхлопных газов и использует эту информацию для управления системой впрыска топлива. Один датчик кислорода установлен выше автомобильного катализатора, то есть ближе к двигателю, чем сам преобразователь. Этот датчик говорит компьютеру двигателя, сколько кислорода содержится в выхлопе. Компьютер двигателя уменьшает или увеличивает количество кислорода в выхлопных газах за счет регулировки количества воздуха, поступающего к топливу. Эта схема позволяет контролировать двигатель компьютера, чтобы убедиться, что двигатель работает на соотношении, близком к стехиометрической точке, а также чтобы убедиться, что в выхлопных газах достаточно кислорода для работы окислительного катализатора для окисления несгоревших углеводородов и СО.
Каталитический преобразователь проделывает большую работу по уменьшению загрязнения окружающей среды, но его производительность может быть существенно улучшена. Одним из недостатков является то, что каталитический преобразователь работает только при достаточно большой температуре. Когда вы только заводите машину, каталитический преобразователь почти не работает.
Простое решение этой проблемы состоит в том, чтобы передвинуть каталитический преобразователь ближе к двигателю. Тогда выхлопные газы, поступающие в каталитический преобразователь, будут более горячими,и он нагреется быстрее, но это одновременно сокращает срок службы конвертера из-за воздействия чрезмерно высоких температур. Большинство автопроизводителей размещает каталитический преобразователь под передним пассажирским сиденьем, достаточно далеко от двигателя, именно для того, чтобы высокие температуры не вредили ему.
Подогрев каталитического преобразователя — хороший способ снижения выбросов. Самый простой способ подогреть катализатор — использование электрических нагревателей. К сожалению, 12-вольтовая электрическая система, установленная на большинстве машин, не может нагреть каталитический преобразователь достаточно быстро. Большинство людей не будет ждать несколько минут, пока нагреется каталитический преобразователь. Гибридные машины имеют большие, высоковольтные батареи, которые могут достаточно быстро нагреть автомобильный катализатор.
К сожалению, 12-вольтовая электрическая система, установленная на большинстве машин, не может нагреть каталитический преобразователь достаточно быстро. Большинство людей не будет ждать несколько минут, пока нагреется каталитический преобразователь. Гибридные машины имеют большие, высоковольтные батареи, которые могут достаточно быстро нагреть автомобильный катализатор.
Каталитические преобразователи дизельных двигателей плохо справляются с сокращением выбросов NOx. Одна из причин в том, что дизельные двигатели сами по себе функционируют в более низком температурном режиме, чем обычные, а преобразователи работают лучше при нагреве. Некоторые ведущие эксперты в области «зеленого» автомобилестроения придумали новую выхлопную систему, которая помогает исправить этот недостаток. Они впрыскивают водный раствор мочевины в выхлопную трубу до того, как газы достигнут преобразователя. При этом возникает химическая реакция, которая уменьшает количество NOx. Карбамид, также известный как мочевина — органическое соединение углерода, азота, кислорода и водорода. Его можно обнаружить в моче млекопитающих и земноводных, что и объясняет такое название. Мочевина реагирует с NOx с получением азота и водяного пара, снижая количество оксидов азота в выхлопных газах более чем на 90 процентов.
Его можно обнаружить в моче млекопитающих и земноводных, что и объясняет такое название. Мочевина реагирует с NOx с получением азота и водяного пара, снижая количество оксидов азота в выхлопных газах более чем на 90 процентов.
Катализ и катализаторы — Энциклопедия wiki.MPlast.by
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Автор: Метельский А.В
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
DOE объясняет .
 .. Катализаторы | Министерство энергетики
.. Катализаторы | Министерство энергетикиКатализатор — это вещество, которое ускоряет химическую реакцию или снижает температуру или давление, необходимые для ее начала, но при этом само не расходуется во время реакции. Катализ — это процесс добавления катализатора для облегчения реакции.
Во время химической реакции связи между атомами в молекулах разрываются, перестраиваются и восстанавливаются, рекомбинируя атомы в новые молекулы.Катализаторы делают этот процесс более эффективным за счет снижения энергии активации , которая является энергетическим барьером, который необходимо преодолеть для протекания химической реакции. В результате катализаторы облегчают атомам разрыв и образование химических связей для образования новых комбинаций и новых веществ.
Использование катализаторов приводит к более быстрым и энергоэффективным химическим реакциям. Катализаторы также имеют ключевое свойство, называемое селективностью , с помощью которого они могут направлять реакцию для увеличения количества желаемого продукта и уменьшения количества нежелательных побочных продуктов. Они могут производить совершенно новые материалы с совершенно новыми возможностями использования.
Они могут производить совершенно новые материалы с совершенно новыми возможностями использования.
За последние несколько десятилетий ученые разработали все более специализированные катализаторы для важных реальных приложений. В частности, мощные катализаторы изменили химическую промышленность. Эти достижения привели к появлению биоразлагаемых пластиков, новых фармацевтических препаратов, а также экологически безопасных видов топлива и удобрений.
Управление науки Министерства энергетики США: вклад в исследования катализаторов
Программа фундаментальных энергетических наук Министерства энергетики (DOE) активно поддерживает фундаментальные исследования катализаторов.DOE фокусируется на разработке новых катализаторов и использовании катализаторов для контроля химических превращений на молекулярном и субмолекулярном уровнях. Исследования Министерства энергетики делают упор на понимание этих реакций и на то, как сделать их более эффективными и целенаправленными. Главная цель Министерства энергетики — разработать новые концепции катализа и новых катализаторов, чтобы помочь промышленности производить топливо и химические вещества из ископаемого и возобновляемого сырья более эффективно и устойчиво. Это исследование помогает продвигать солнечное топливо, которое компании производят с использованием солнца и обычных химикатов, таких как углекислый газ и азот.Это исследование также создает передовые методы преобразования использованного пластика в новые продукты.
Главная цель Министерства энергетики — разработать новые концепции катализа и новых катализаторов, чтобы помочь промышленности производить топливо и химические вещества из ископаемого и возобновляемого сырья более эффективно и устойчиво. Это исследование помогает продвигать солнечное топливо, которое компании производят с использованием солнца и обычных химикатов, таких как углекислый газ и азот.Это исследование также создает передовые методы преобразования использованного пластика в новые продукты.
Быстрые факты
- Люди используют катализаторы тысячи лет. Например, дрожжи, которые мы используем для приготовления хлеба, содержат ферменты, которые являются естественными катализаторами, которые способствуют превращению муки в хлеб.
- Нобелевская премия по химии 2005 г. была присуждена трем исследователям (Ив Шовен, Роберт Х. Граббс и Ричард Р. Шрок) за их работу над катализаторами метатезиса.Доктора Граббс и Шрок были частично профинансированы Министерством энергетики на их исследования, получившие Нобелевскую премию.
 Доктор Шрок продолжает финансироваться Министерством энергетики США.
Доктор Шрок продолжает финансироваться Министерством энергетики США. - Нобелевская премия по химии 2018 г. была присуждена Фрэнсис Х. Арнольд за ее новаторскую работу по управлению эволюцией ферментов для таких безвредных для окружающей среды приложений, как возобновляемые виды топлива. Частично она финансируется Министерством энергетики США.
- Посетите аргоннскую национальную лабораторию, чтобы узнать еще семь вещей о катализе, которых вы, возможно, не знали.
Ресурсы
Научные термины могут сбивать с толку.DOE Explains предлагает простые объяснения ключевых слов и концепций фундаментальной науки. В нем также описывается, как эти концепции применяются к работе, которую проводит Управление науки Министерства энергетики США, поскольку это помогает Соединенным Штатам преуспевать в исследованиях во всем научном спектре.
7 фактов о катализе, которых вы можете не знать
Практически все в вашей повседневной жизни зависит от катализаторов: автомобили, стикеры, стиральный порошок, пиво. Все части вашего бутерброда — хлеб, сыр чеддер, жареная индейка. Катализаторы разрушают бумажную массу, чтобы получить гладкую бумагу в вашем журнале. Они очищают ваши контактные линзы каждую ночь. Они превращают молоко в йогурт, а нефть — в пластиковые молочники, компакт-диски и велосипедные шлемы.
Все части вашего бутерброда — хлеб, сыр чеддер, жареная индейка. Катализаторы разрушают бумажную массу, чтобы получить гладкую бумагу в вашем журнале. Они очищают ваши контактные линзы каждую ночь. Они превращают молоко в йогурт, а нефть — в пластиковые молочники, компакт-диски и велосипедные шлемы.
Катализаторы ускоряют химическую реакцию, снижая количество энергии, необходимое для ее запуска. Катализ — это основа многих промышленных процессов, в которых используются химические реакции для превращения сырья в полезные продукты.Катализаторы являются неотъемлемой частью производства пластмасс и многих других промышленных изделий.
Даже человеческий организм работает на катализаторах. Многие белки в вашем теле на самом деле являются катализаторами, называемыми ферментами, которые делают все: от создания сигналов, которые двигают ваши конечности, до помощи в переваривании пищи. Они действительно важная часть жизни.
Маленькие вещи могут иметь большие результаты.
В большинстве случаев вам нужно совсем небольшое количество катализатора, чтобы изменить ситуацию. Даже размер частицы катализатора может изменить ход реакции.В прошлом году аргоннская команда, в которую входил ученый-материаловед Ларри Кертисс, обнаружила, что один серебряный катализатор лучше справляется со своей задачей, когда он находится в наночастицах шириной всего в несколько атомов. (Катализатор превращает пропилен в оксиды пропилена, что является первым шагом в производстве антифриза и других продуктов.)
Это может сделать вещи более экологичными. Промышленные процессы производства пластмассы и других предметов первой необходимости часто приводят к появлению неприятных побочных продуктов, которые могут представлять опасность для здоровья человека и окружающей среды.Лучшие катализаторы могут помочь решить эту проблему. Например, тот же серебряный катализатор на самом деле производит меньше токсичных побочных продуктов, что делает всю реакцию более экологически чистой.
По сути, катализатор — это способ экономии энергии. А применение катализаторов в больших масштабах может спасти мир на лотов и единиц энергии. Три процента всей энергии, используемой в США каждый год, идет на преобразование этана и пропана в алкены, которые, помимо прочего, используются для производства пластмасс.Это эквивалент более 500 миллионов баррелей бензина.
Катализаторы также являются ключом к открытию биотоплива. Вся биомасса — кукуруза, просо, деревья — содержит твердое соединение, называемое целлюлозой, которое необходимо расщепить для получения топлива. Поиск идеального катализатора для дезинтеграции целлюлозы сделает биотопливо более дешевым и более жизнеспособным в качестве возобновляемого источника энергии.
Вычислительное моделирование открывает перспективы для создания лучших катализаторов и красивых изображений, таких как эта модель платинового катализатора, взаимодействующего с атомами кислорода (красный) и атомами водорода (белый). Изображение Риза Ранкина, Центр наномасштабных материалов. Часто мы не понимаем, почему они работают.
Изображение Риза Ранкина, Центр наномасштабных материалов. Часто мы не понимаем, почему они работают. Точные причины, по которым катализаторы работают, часто остаются загадкой для ученых. Curtiss работает в области вычислительного катализа: использует компьютеры для решения сложного взаимодействия физики, химии и математики, которое объясняет, как работает катализатор.
Разобравшись в процессе, ученые могут попытаться создать катализатор, который работает еще лучше, путем моделирования того, как могут работать различные материалы.Возможные конфигурации новых катализаторов могут составлять тысячи комбинаций, поэтому суперкомпьютеры лучше всего справляются с ними.
Когда Эдисон создавал лампочку, он испытал буквально сотни различных нитей накала (вероятно, испытав терпение своих лаборантов), прежде чем обнаружил обугленную нить. Воспользовавшись суперкомпьютерами и современными технологиями, ученые могут ускорить годы испытаний и сократить расходы, чтобы совершить прорыв.
Curtiss проводит моделирование на суперкомпьютере Argonne Blue Gene / P для разработки возможных новых катализаторов.«По мере того, как суперкомпьютеры становятся быстрее, мы можем делать то, чего никогда не могли делать 10 лет назад», — сказал он.
Они могут оказаться незаменимыми для следующей большой революции в производстве аккумуляторов. Новые эффективные литий-ионные аккумуляторы помогли превратить неуклюжие автомобильные телефоны в тонкие и элегантные сотовые телефоны и ноутбуки, доступные сегодня. Но ученые уже ищут следующую революцию в аккумуляторных батареях — такую, которая когда-нибудь сможет сделать батарею легкой и достаточно мощной, чтобы проехать 500 миль на машине.Перспективной идеей являются литий- воздушные батареи , в которых в качестве основного компонента используется кислород воздуха. Но эта новая батарея потребует полностью изменить внутреннюю химию, и ей понадобится новый мощный катализатор, чтобы заставить ее работать. Литий-воздушная батарея работает, объединяя атомы лития и кислорода, а затем снова и снова разрушая их. Это ситуация, специально созданная для катализатора, и хороший катализатор ускорит реакцию и сделает батарею более эффективной.
Литий-воздушная батарея работает, объединяя атомы лития и кислорода, а затем снова и снова разрушая их. Это ситуация, специально созданная для катализатора, и хороший катализатор ускорит реакцию и сделает батарею более эффективной.
Понимание химии реакций — это первый шаг; затем ученые могут использовать моделирование для разработки потенциальных новых катализаторов и тестирования их в лаборатории.Но этот первый шаг будет трудным, если вы не сможете перейти на атомарный уровень, чтобы увидеть, что происходит во время реакции. Именно здесь блистают большие научные объекты, такие как усовершенствованный источник фотонов (APS) в Аргонне.
В APS ученые могут использовать самые яркие рентгеновские лучи в Соединенных Штатах, чтобы отслеживать реакции в режиме реального времени. В Центре электронной микроскопии лаборатории исследователи фотографируют атомы во время их реакции. Кертисс и его команда использовали и то, и другое в поисках лучших катализаторов.
| Что такое катализ? Катализ — это химическая реакция, вызванная катализатором. Катализатор химическая версия «свахи», потому что физически объединяет два химических вещества таким образом, что их шанс на реакцию максимально.  Однако катализаторы не могут сочетать химические вещества, если нет «химия.» Вместо этого они позволяют реагировать на происходят быстрее, достаточно быстро, чтобы их можно было использовать для очистки окружающей среды или для производства химический продукт. Катализаторы бывают разных форм. Некоторые из них представляют собой пористые твердые вещества, такие как платина, родиевые и палладиевые сетки, удаляющие оксид азота из автомобиля выхлоп. Другие представляют собой белковые молекулы, называемые ферментами, которые содержатся в в микроорганизмах.Третьи — это твердые вещества, встречающиеся в природе, такие как иксиды марганца или железа. Однако независимо от структуры катализатора, он ускоряет реакции, не изменяясь при этом. Сильная сторона Центра катализа и поверхностных исследований и
Институт экологического катализа — это экспертный и научный
интуиция его исследователей. Например, используя передовые методы электронной микроскопии, Лоуренс Маркс, профессор материаловедения и инженерии, и Винаяк Дравид, доцент кафедры материаловедения и инженерии, сфотографировать электронная структура катализаторов с точностью до нанометра. Разведка отдельного след, Питер Стэр, профессор химии; Эрик Вельц, профессор химии; и Рэндалл Снурр, доцент кафедры химического машиностроения, на карте происходит со временем — с побочными продуктами реакции, а также с оригинальные химикаты. Линда Бродбелт, доцент кафедры химического машиностроения; Дональд
Эллис, профессор химии, физики и астрономии; Snurr; и Роберт
Чжоу из UOP LLC в Дес-Плейнс, штат Иллинойс, смоделировал эти атомные и субатомные
изменения на компьютерах, сбор информации о кластерах и о том, как
их электроны ведут себя. — М.М. ВЕРНУТЬСЯ К ИСТОРИЯМ |
Что такое катализ — Катализный клуб Филадельфии
Что такое катализ или катализ и что?
Это короткое сообщение предназначено для объяснения того, что такое катализ.Бесчисленное количество раз меня спрашивали о том, что такое катализатор, от людей разного происхождения: иммиграционных служащих, четверых на поле для гольфа, руководителей в самолетах или соседей. Для тех из нас, кто работает в этой области, мы видим огромную ценность, которая неоднократно подтверждалась исследованиями влияния катализа на финансовые инструменты измерения, такие как ВНП (валовой национальный продукт), но мы должны быть в состоянии объяснить нашу профессию. тем, кто не знаком с технологией.
Катализ — это технология, которая увеличивает скорость химической реакции. В этой технической области работают как ученые, так и инженеры. Катализаторы — это материалы, которые эти люди используют для исследования явления катализа. Катализаторы — это материалы, которые ускоряют химические реакции без израсходования катализатора; это материалы, которые вызывают изменения. Более конкретно, катализаторы — это материалы, которые изменяют скорость достижения химического равновесия, но сами по себе не изменяются или не расходуются в процессе.Катализаторы также обеспечивают селективность или специфичность для конкретных продуктов, которые более желательны, чем другие. Все эти атрибуты катализа и катализаторов приводят к экономии энергии, меньшему загрязнению, меньшему количеству побочных продуктов, более дешевым реакторным материалам и, в конечном итоге, продуктам, которые уменьшают глобальное потепление. Было сказано (А. Митташ), что «химия без катализа была бы мечом без ручки… или колоколом без звука».
Катализаторы — это материалы, которые ускоряют химические реакции без израсходования катализатора; это материалы, которые вызывают изменения. Более конкретно, катализаторы — это материалы, которые изменяют скорость достижения химического равновесия, но сами по себе не изменяются или не расходуются в процессе.Катализаторы также обеспечивают селективность или специфичность для конкретных продуктов, которые более желательны, чем другие. Все эти атрибуты катализа и катализаторов приводят к экономии энергии, меньшему загрязнению, меньшему количеству побочных продуктов, более дешевым реакторным материалам и, в конечном итоге, продуктам, которые уменьшают глобальное потепление. Было сказано (А. Митташ), что «химия без катализа была бы мечом без ручки… или колоколом без звука».
Катализ — ключ к жизни и образу жизни.Это важная технология для производства химикатов и материалов, для топливных элементов и других систем преобразования энергии, для устройств сжигания и для систем контроля загрязнения, которые оказывают огромное влияние на всех жителей нашей планеты. Некоторые другие конкретные примеры того, что действительно делают катализаторы, включают приложения для:
Некоторые другие конкретные примеры того, что действительно делают катализаторы, включают приложения для:
Топливо и энергия : Более половины бензина в мире в настоящее время производится с помощью процесса, разработанного в 1942 году и получившего название каталитического крекинга в псевдоожиженном слое (FCC).Этот процесс произвел революцию в нефтяной промышленности за счет более эффективного преобразования высококипящих масел в более легкие и пригодные для использования продукты. FCC производит бензин, а также топочный мазут, мазут, пропан, бутан и химическое сырье, которое играет важную роль в производстве других продуктов, таких как пластмассы, синтетические каучуки и ткани, а также косметики. Считается одним из важнейших достижений химической инженерии ХХ века. В будущем катализаторы будут использоваться для производства чистой энергии из возобновляемых источников энергии, таких как водород для топливных элементов и транспортное топливо из непищевой биомассы.
Выбросы : Автомобильные катализаторы выбросов разрабатываются с 1960-х годов для уничтожения выбросов CO, NOx и углеводородов от мобильных транспортных средств. Катализаторы также используются для уничтожения источников выбросов серы при сжигании топлива. Кроме того, катализаторы широко используются для уничтожения нежелательных выбросов угольных электростанций в мире.
Полимеры : Катализаторы также используются в производстве мировых полимеров.Текущие примеры полимеров включают клеи, покрытия, пену и упаковочные материалы, текстильные и промышленные волокна, композиты, электронные устройства, биомедицинские устройства, оптические устройства и прекурсоры для многих недавно разработанных высокотехнологичных керамических материалов.
Жизнь : Ферменты — один из примеров катализаторов в нашем организме, которые имеют решающее значение для поддержания жизни. Кроме того, возможность анализа генов и, в конечном итоге, манипулирования ими основывается на каталитических свойствах РНК для репликации молекул, содержащих биологическую информацию.
Здравоохранение : В фармацевтической промышленности используется большое количество катализаторов, необходимых для производства требуемых продуктов. Катализаторы, используемые при производстве лекарств, используются для спасения жизней и улучшения здоровья и образа жизни людей во всем мире.
Продукты питания : Катализаторы широко используются в пищевой промышленности и повышают эффективность других потребительских товаров, таких как моющие средства для стирки.
Экономический вклад катализа так же примечателен, как и само явление.Четыре сектора мировой экономики — это нефть, производство энергии, производство химикатов и пищевая промышленность; вместе они составляют более 10 триллионов долларов мирового ВНП, и все они критически зависят от использования катализаторов. По оценкам, катализ составляет более 35% мирового ВВП; большая часть этого вклада поступает от производства высокоэнергетического топлива (например, бензина, дизельного топлива, водорода), которое критически зависит от использования небольших количеств катализаторов на нефтеперерабатывающих заводах нашего мира. Как бизнес, сам рынок катализаторов растет с нынешних 12 миллиардов долларов США, так что затраты на катализ намного меньше 0,1% выручки от продаж продуктов, которые они создают.
Как бизнес, сам рынок катализаторов растет с нынешних 12 миллиардов долларов США, так что затраты на катализ намного меньше 0,1% выручки от продаж продуктов, которые они создают.
Тем, кто ищет дополнительную информацию и другие подробные примеры того, что такое катализ, делает или ценность, которую он предоставляет, мы рекомендуем дополнительно изучить образовательные подпапки на веб-сайте Североамериканского каталитического общества. Это некоммерческая профессиональная организация, в которую входят более 1500 ученых и инженеров, работающих в области катализа.Веб-сайт Общества www .nacat soc .org предоставляет членам и общественности информацию о профессиональной деятельности, а также папки, содержащие информацию по науке о катализе. Другой ресурс — превосходный учебник: Основы промышленных каталитических процессов К. Х. Бартоломью и Роберта Дж. Фаррауто, изданный John Wiley & Sons; 2 -е издание (2005 г.), ISBN-13: 978–0471457138.
John Armor
Glob al Catalysis. com
com
Февраль 2008 г.
(с предложениями Боба Фаррауто и Энрике Иглесии)
Катализ в промышленности
Катализаторы — это вещества, которые ускоряют реакции, обеспечивая альтернативный путь разрыва и образования связей. Ключом к этому альтернативному пути является более низкая энергия активации, чем та, которая требуется для некаталитической реакции.
Катализаторы часто специфичны для одной конкретной реакции, особенно для ферментов, которые катализируют биологические реакции, например, при ферментации углеводов для производства биотоплива.
Промышленные компании и исследовательские лаборатории университетов проводят много фундаментальных и прикладных исследований, чтобы выяснить, как работают катализаторы, и повысить их эффективность. Если каталитическую активность можно улучшить, можно будет снизить температуру и / или давление, при которых работает процесс, и, таким образом, сэкономить топливо, что является одной из основных затрат в крупномасштабном химическом процессе. Кроме того, можно уменьшить количество реагентов, которые тратятся впустую с образованием нежелательных побочных продуктов.
Кроме того, можно уменьшить количество реагентов, которые тратятся впустую с образованием нежелательных побочных продуктов.
Если катализатор находится в той же фазе, что и реагенты, его называют гомогенным катализатором . С другой стороны, гетерогенный катализатор находится в фазе, отличной от фазы реагентов и продуктов, и его часто предпочитают в промышленности, поскольку он легко отделяется от продуктов, хотя он часто менее специфичен и позволяет протекать побочным реакциям.
Гетерогенный катализ
Наиболее распространенные примеры гетерогенного катализа в промышленности включают реакции газов, проходящих по поверхности твердого тела, часто металла, оксида металла или цеолита (Таблица 1).
Таблица 1 Примеры промышленных процессов с использованием гетерогенного катализа.
Молекулы газа взаимодействуют с атомами или ионами на поверхности твердого тела. Первый процесс обычно включает образование очень слабых межмолекулярных связей, процесс, известный как физисорбция, с последующим образованием химических связей, процесс, известный как хемосорбция.
Физисорбцию можно сравнить с физическим процессом, например с разжижением. Действительно, изменения энтальпии, которые происходят при физической адсорбции, составляют примерно от -20 до -50 кДж моль -1 , аналогично изменениям энтальпии, когда газ конденсируется с образованием жидкости.Энтальпии хемосорбции аналогичны значениям, найденным для энтальпий реакции. У них очень широкий диапазон, как и у некаталитических химических реакций.
Примером ступенчатых процессов, которые происходят при гетерогенном катализе, является окисление монооксида углерода до диоксида углерода над палладием. Это очень важный процесс в повседневной жизни. Автомобили оснащены каталитическими нейтрализаторами. Они состоят из металлического корпуса, в котором два металла, палладий и родий, очень тонко диспергированы на поверхности керамической основы, напоминающей соты из отверстий.Преобразователь размещается между двигателем и выходом выхлопной трубы.
Выхлопные газы содержат монооксид углерода и несгоревшие углеводороды, которые реагируют с избыточным кислородом с образованием диоксида углерода и водяного пара, причем реакция катализируется в основном палладием:
Выхлопные газы также содержат оксид азота (II) (оксид азота, NO), который удаляется реакциями, катализируемыми главным образом родием:
Принятый механизм окисления окиси углерода до двуокиси углерода включает хемосорбцию как молекул окиси углерода, так и молекул кислорода на поверхности металлов. Молекулы адсорбированного кислорода диссоциируют на отдельные атомы кислорода. Каждый из этих атомов кислорода может объединяться с хемосорбированной молекулой монооксида углерода с образованием молекулы диоксида углерода. Затем молекулы диоксида углерода десорбируются с поверхности катализатора. Представление этих шагов показано на рисунке 1.
Молекулы адсорбированного кислорода диссоциируют на отдельные атомы кислорода. Каждый из этих атомов кислорода может объединяться с хемосорбированной молекулой монооксида углерода с образованием молекулы диоксида углерода. Затем молекулы диоксида углерода десорбируются с поверхности катализатора. Представление этих шагов показано на рисунке 1.
Рис. 1 Механизм окисления окиси углерода.
Каждая из этих стадий имеет гораздо более низкую энергию активации, чем гомогенная реакция между монооксидом углерода и кислородом.
Удаление монооксида углерода, несгоревших углеводородов и оксида азота (II) из выхлопных газов автомобилей и грузовиков очень важно, поскольку эта смесь приводит к фотохимическому смогу, который усугубляет респираторные заболевания, такие как астма.
Платина, палладий и родий используются, но это очень дорогие металлы, и каждый из них действительно дороже золота. В последнее время много работы было посвящено созданию катализаторов с очень маленькими частицами металлов, что является примером достижений нанотехнологий.
Это не просто способность поверхности гетерогенного катализатора взаимодействовать с молекулами реагента, хемосорбция, что делает его хорошим катализатором. Если адсорбция является слишком экзотермической, т.е. энтальпия хемосорбции слишком высока, дальнейшая реакция, вероятно, будет слишком эндотермической, чтобы протекать. Энтальпия хемосорбции должна быть достаточно экзотермической, чтобы происходила хемосорбция, но не настолько высокой, чтобы не допустить протекания дальнейшей реакции. Например, при окислении монооксида углерода молибден на первый взгляд может быть предпочтительным выбором, поскольку кислород легко хемосорбируется металлом.Однако образующиеся атомы кислорода не вступают в дальнейшую реакцию, поскольку они слишком сильно адсорбируются на поверхности. Платина и палладий, с другой стороны, имеют более низкие энтальпии хемосорбции с кислородом, и тогда атомы кислорода могут далее реагировать с адсорбированным монооксидом углерода.
Еще один момент, который следует учитывать при выборе катализатора, заключается в том, что продукт не должен иметь возможность слишком сильно адсорбироваться на его поверхности. Двуокись углерода не адсорбируется на платине и палладии, поэтому быстро десорбируется в газовую фазу.
Двуокись углерода не адсорбируется на платине и палладии, поэтому быстро десорбируется в газовую фазу.
Свидетельством важности катализа сегодня является присуждение Нобелевской премии по химии в 2007 году Герхарду Эртлю за его работу по выяснению, среди других процессов, механизма синтеза аммиака (процесс Габера):
Эртль получил важные доказательства того, как железо катализирует диссоциацию молекул азота и молекул водорода, приводящую к образованию аммиака.
(Рисунок 2):
Рисунок 2 Механизм каталитического синтеза аммиака.
На рис. 3 показано, как барьеры энергии активации намного ниже, чем расчетный барьер энергии активации (который должен составлять не менее 200 кДж / моль) для некаталитического синтеза аммиака.
Рис. 3 Энергетические барьеры активации реакций, протекающих при каталитическом синтезе аммиака.
Общие требования к гетерогенному катализатору
Чтобы быть успешным, катализатор должен позволять реакции протекать с подходящей скоростью в условиях, которые являются экономически желательными, при как можно более низких температуре и давлении. Он также должен быть длительным. Некоторые реакции приводят к появлению нежелательных побочных продуктов. Например, при крекинге газойля образуется углерод, который откладывается на поверхности катализатора, цеолита, и приводит к быстрому ухудшению его эффективности. Многие катализаторы склонны к отравлению, которое происходит, когда примесь прикрепляется к поверхности катализатора и препятствует адсорбции реагентов. Незначительные следы такого вещества могут испортить процесс. Одним из примеров является диоксид серы, который отравляет поверхность платины и палладия.Таким образом, все следы соединений серы должны быть удалены из бензина, используемого в автомобилях с каталитическими нейтрализаторами.
Он также должен быть длительным. Некоторые реакции приводят к появлению нежелательных побочных продуктов. Например, при крекинге газойля образуется углерод, который откладывается на поверхности катализатора, цеолита, и приводит к быстрому ухудшению его эффективности. Многие катализаторы склонны к отравлению, которое происходит, когда примесь прикрепляется к поверхности катализатора и препятствует адсорбции реагентов. Незначительные следы такого вещества могут испортить процесс. Одним из примеров является диоксид серы, который отравляет поверхность платины и палладия.Таким образом, все следы соединений серы должны быть удалены из бензина, используемого в автомобилях с каталитическими нейтрализаторами.
Кроме того, твердые катализаторы намного более эффективны, если они тонко измельчены, поскольку это увеличивает площадь поверхности.
Рисунки 4 и 5 Два способа увеличения площади поверхности катализатора.
На рисунке 4 платино-родиевый сплав (используемый при производстве азотной кислоты) имеет форму очень тонкой проволоки, из которой соткана сетка. С любезного разрешения Джонсон Матти. На рисунке 5 оксид ванадия (V) (используемый при производстве серной кислоты) был получен в форме ромашки. С любезного разрешения Haldor Topsøe A / S. |
При высоких температурах частицы мелкодисперсного катализатора имеют тенденцию сливаться вместе, и порошок может «спекаться», процесс, известный как спекание . Это снижает активность катализатора, и необходимо принять меры, чтобы этого избежать.Один из способов — добавить другое вещество, известное как промотор . Когда железо используется в качестве катализатора в процессе Габера, добавляется оксид алюминия, который действует как барьер для плавления металлических частиц. Добавляется второй промотор, оксид калия, который, по-видимому, вызывает более легкую хемосорбцию атомов азота, тем самым ускоряя самую медленную стадию в схеме реакции.
Рис. 6 Платино-родиевая сетка используется в качестве катализатора в реакции между аммиаком и метаном для получения цианистого водорода, промежуточного продукта при производстве метил-2-метилпропеноата.Сетка работает при температуре 1270 К и поэтому светится. Фотография сделана через смотровое стекло, расположенное на реакторе. 6 Платино-родиевая сетка используется в качестве катализатора в реакции между аммиаком и метаном для получения цианистого водорода, промежуточного продукта при производстве метил-2-метилпропеноата.Сетка работает при температуре 1270 К и поэтому светится. Фотография сделана через смотровое стекло, расположенное на реакторе. |
Оксид алюминия, диоксид кремния, алюмосиликаты и цеолиты
Одна из наиболее важных реакций, в которых оксид алюминия , Al 2 O 3 (часто называемый оксидом алюминия) принимает участие в промышленной реакции, заключается в платформинге, в котором нафта реформируется над оксидом алюминия, пропитанным платиной. или рений.И оксид, и металлы играют каталитическую роль, что является примером бифункционального катализа. На поверхности оксида алюминия имеются гидроксильные группы, которые, по сути, являются отрицательно заряженными центрами, к которым присоединен ион водорода, который может действовать как кислотный катализатор.
Диоксид кремния (диоксид кремния) — еще один кислый оксид, используемый в промышленности. Он становится особенно активным, если покрыт кислотой (например, фосфорной кислотой), тем самым увеличивая количество активных кислотных центров.Например, производство этанола достигается путем гидратации этена с использованием диоксида кремния, покрытого фосфорной кислотой:
Механизм включает образование карбокатиона (рисунок 7):
Рис. 7 Механизм гидратации этена в этанол.
Алюмосиликаты также используются в качестве катализаторов, когда требуется кислотный центр. Они сделаны из диоксида кремния (кремнезема) и оксида алюминия. Они содержат силикат-ионы SiO 4 4-, которые имеют тетраэдрическую структуру, которая может быть связана между собой несколькими способами.Когда некоторые из атомов Si заменяются атомами Al, в результате получается алюмосиликат. Ионы водорода снова связаны с атомами алюминия:
Катализаторы цеолитные
Особый класс алюмосиликатов, вызвавший огромный интерес в последние годы, — это цеолиты. Существует много разных цеолитов из-за различного расположения атомов. Их структура из силикатных и алюминатных ионов может иметь большие свободные пространства в трехмерных структурах, которые дают место для катионов, таких как натрий и кальций, и молекул, таких как вода.Пространства связаны между собой и образуют длинные каналы и поры, которые имеют разный размер в разных цеолитах.
Существует много разных цеолитов из-за различного расположения атомов. Их структура из силикатных и алюминатных ионов может иметь большие свободные пространства в трехмерных структурах, которые дают место для катионов, таких как натрий и кальций, и молекул, таких как вода.Пространства связаны между собой и образуют длинные каналы и поры, которые имеют разный размер в разных цеолитах.
Рисунок 8 Структура цеолита (пример рисунка)
Цеолит, который обычно используется во многих каталитических реакциях, — это ZSM-5, который получают из алюмината натрия (раствор оксида алюминия в водном гидроксиде натрия) и коллоидного раствора диоксида кремния, гидроксида натрия, серной кислоты и бромида тетрапропиламмония.
Это, например, очень эффективный катализатор для превращения метилбензола (толуола) в три диметилбензола (ксилолы).Увы, полученная смесь содержит только около 25% 1,4-диметилбензола (п-ксилола), изомера, необходимого для производства сложных полиэфиров, а остальные 1,2- (о-ксилола) и 1,3-диметилбензолов ( м-ксилол), не требуется в таких больших количествах.
Однако, если цеолит промыть фосфорной кислотой и сильно нагреть, мельчайшие частицы оксида фосфора (V) откладываются на поверхности, делая поры немного меньше. Это ограничивает диффузию 1,2- и 1,3-изомеров, и они удерживаются в порах до тех пор, пока не превратятся в 1,4-изомер и не смогут выйти (рис. 9).
Эта замечательная селективность позволяет увеличить выход 1,4-изомера с 25% до 97%.
| Рис. 9 Цеолит, действующий как молекулярное сито и катализатор во время образования 1,4-диметилбензола из метилбензола. |
Способность цеолита адсорбировать одни молекулы и отклонять другие дает ему способность действовать как молекулярное сито. Например, при производстве этанола из этена или из биомассы получают водный раствор этанола, в котором 4% воды все еще присутствует даже после повторных дистилляций.Дальнейшая очистка этанола требует использования цеолита, который предпочтительно поглощает воду. В таблице 2 приведены примеры промышленных процессов с использованием цеолитов.
В таблице 2 приведены примеры промышленных процессов с использованием цеолитов.
Таблица 2 Примеры промышленных процессов с использованием цеолитов.
Катализаторы бифункциональные
Бифункциональные катализаторы способны, как следует из названия, катализировать превращение одного соединения в другое, используя два вещества на поверхности.
Например, при риформинге нафты (смеси алканов с прямой цепью с 6-10 атомами углерода) используется бифункциональный катализатор.Самый известный из них — это пропитка платиной поверхности оксида алюминия, и в этом процессе и металл, и оксид играют свою роль. Как можно видеть (рис. 10), первым этапом является дегидрирование алканов до алкенов, катализируемое металлом, за которым в конечном итоге следует адсорбция молекул алкена на оксиде алюминия. Поскольку задействована платина, реформинг иногда называют платформой . Водород обеспечивает последующую реакцию образующихся алкенов и циклоалкенов с водородом с образованием насыщенных соединений.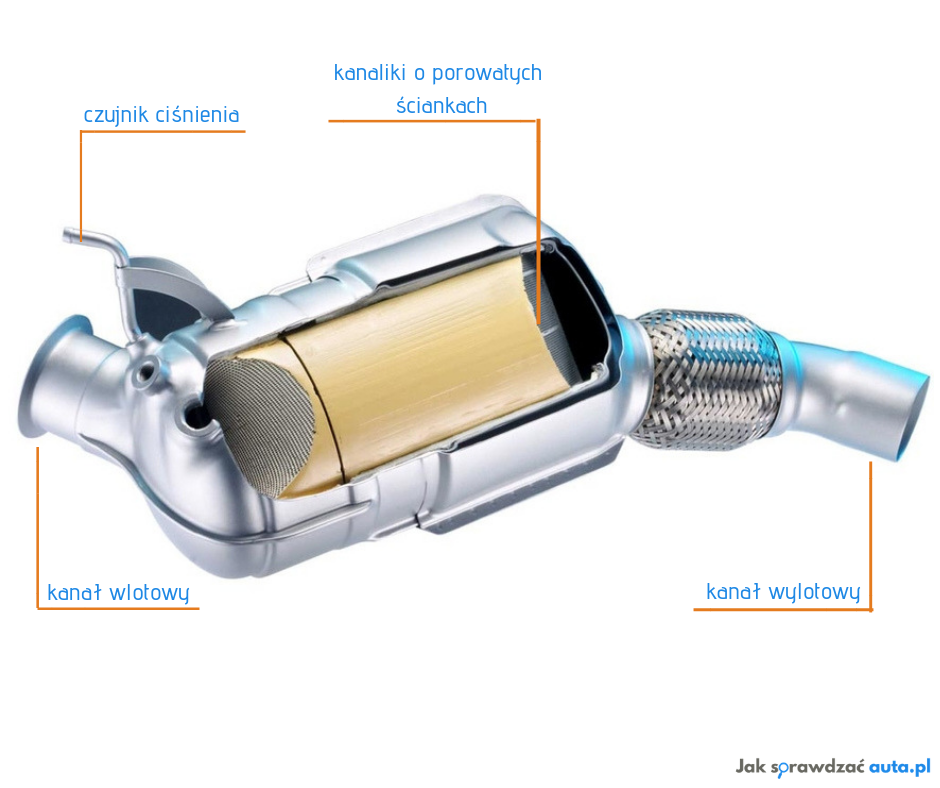
В этом примере бутан дегидрируется до бутена.
Рис. 10 Механизм преобразования бутана в 2-метилпропен (изобутен).
Разветвленная молекула алкена десорбируется в газовую фазу до тех пор, пока она не реадсорбируется на участке металла, где она гидрируется с образованием разветвленного алкана, 2-метилпропана (изобутана), который затем десорбируется в газовую фазу.
В промышленном процессе пары нафты проходят над платиной и рением ( около 0.По 3%), которые тонко диспергированы над оксидом алюминия.
Считается, что рений играет интересную роль. Если соединение серы может проходить по поверхности катализатора, оно предпочтительно адсорбируется рением. Если соединения серы не удаляются, происходят реакции, приводящие в конечном итоге к образованию углерода, который вызывает заметное снижение активности катализатора.
Алканы с разветвленной цепью имеют гораздо более высокое октановое число, чем алканы с прямой цепью. Теперь не только алканы разветвляются, но также образуются циклоалканы и из них ароматические углеводороды. Все три класса углеводородов имеют более высокое октановое число, чем нафта. Помимо оксида алюминия и диоксида кремния, другие оксиды являются важными катализаторами. Например, в контактном процессе, используемом для производства серной кислоты, катализатором окисления диоксида серы до триоксида серы является оксид ванадия (V) на поверхности диоксида кремния:
Все три класса углеводородов имеют более высокое октановое число, чем нафта. Помимо оксида алюминия и диоксида кремния, другие оксиды являются важными катализаторами. Например, в контактном процессе, используемом для производства серной кислоты, катализатором окисления диоксида серы до триоксида серы является оксид ванадия (V) на поверхности диоксида кремния:
Сульфат калия добавлен в качестве промотора. Его механизм действия не совсем ясен, но, похоже, это связано с тем, что его присутствие снижает температуру плавления катализатора и позволяет ему растекаться в виде очень тонкого слоя по всей поверхности.
Несколько важных промышленных процессов катализируются смешанными оксидами металлов. Поверхности содержат два или более различных атома металла, ионы O 2- и группы -ОН. Они особенно полезны при окислении углеводородов, где требуется избирательное окисление. Например, пропен можно окислить до пропеналя (акролеина), используя смесь оксидов висмута (III) и молибдена (VI).
Без катализатора пропен окисляется до большого количества органических соединений, включая метаналь и этаналь, и в конечном итоге образует диоксид углерода.Атомы кислорода на поверхности оксида молидена (VI) не очень реакционноспособны, избирательно реагируя с пропеном и разрывая самую слабую связь в алкене с образованием аллильного радикала:
Рисунок 11 Окисление пропена
Аллильный радикал затем окисляется на поверхности с образованием пропеналя. Предполагается, что аллильный радикал окисляется атомом кислорода, который адсорбируется на участке молибдена. Другой атом кислорода, адсорбированный на участке висмута, затем переносится на участок восстановленного молибдена, чтобы заменить этот кислород.Для завершения цикла существует компенсирующий перенос электронов.
Этот же катализатор используется также для производства пропенонитрила:
Гомогенный катализ
Гомогенные катализаторы реже используются в промышленности, чем гетерогенные катализаторы, поскольку по завершении реакции их необходимо отделить от продуктов, что может быть очень дорогостоящим.
Таблица 3 Примеры промышленных процессов с использованием гомогенного катализа.
Однако есть несколько важных промышленных процессов, которые катализируются гомогенно, часто с использованием кислоты или основания (таблица 3).
Одним из примеров является производство этан-1,2-диола из эпоксиэтана, где катализатор представляет собой следы кислоты:
Рис. 12 Механизм образования этан-1,2-диола из эпоксиэтана.
В механизме этой реакции ион водорода добавляется в начале и теряется в конце. Ион водорода действует как катализатор.
Два других примера относятся к производству 2,2,4-триметилпентана из 2-метилпропена, опять же с использованием кислоты в качестве катализатора. Один использует 2-метилпропан (таблица 3), который непосредственно дает алкан. Другой использует только 2-метилпропен.
Механизм реакции также включает добавление иона водорода к реагенту (рис. 13).
Рис. 13 Часть механизма образования 2,4,4-триметил-2-пентена из 2-метилпропена.
Затем алкен гидрируют с использованием никеля в качестве катализатора до 2,2,4-триметилпентана (изооктана):
2,2,4-триметилпентан часто добавляют в бензин, чтобы улучшить его антидетонационные свойства, теперь, когда прекращается использование метил-трет-бутилового эфира (МТБЭ).
Катализаторы реакций полимеризации
Катализаторы Циглера-Натта
Катализаторы Циглера-Натта — это металлоорганические соединения, которые действуют как катализаторы при производстве поли (этена) и поли (пропена).За свою работу по производству полиалкенов Карл Цигелер и Джулано Натта были удостоены Нобелевской премии по химии в 1965 году. Катализаторы готовятся из соединений титана с триалкилом алюминия, который действует как промотор:
Используемые алкильные группы включают этил, гексил и октил.
Роль титанового катализатора можно представить, как показано на рисунке 14.
Алкеновый мономер, например этен или пропен, присоединяется к пустому координационному сайту на атоме титана, и эта молекула алкена затем вставляется в углерод-титановую связь, чтобы удлинить алкильную цепь. Затем этот процесс продолжается, образуя линейный полимер, поли (этен) или поли (пропен).
Затем этот процесс продолжается, образуя линейный полимер, поли (этен) или поли (пропен).
Полимер осаждается, когда катализатор разрушается при добавлении воды. Поскольку он является линейным, молекулы полимера могут плотно упаковываться вместе, что придает полимеру более высокую температуру плавления и плотность, чем у поли (этена), полученного радикальным инициированием.
Рисунок 14, иллюстрирующий роль катализатора Циглера-Натта.
Катализаторы Циглера-Натта не только позволяют получать линейные полимеры, но также могут обеспечивать стереохимический контроль.Пропен, например, может полимеризоваться, даже будучи линейным, тремя способами с образованием атактического, изотактического или синдиотактического поли (пропена).
Однако этот катализатор позволяет вводить пропен только одним способом и получать изотактический полипропилен.
Еще больший контроль полимеризации достигается при использовании нового класса катализаторов — металлоценов.
Радикальная полимеризация
Многие полимеры производятся с использованием радикальных инициаторов, которые действуют как катализаторы (Таблица 4).Например, полимеризация хлорэтилена начинается с его нагревания с помощью небольшого количества пероксида (R-O-O-R):
Рис. 15 Механизм свободнорадикальной полимеризации хлорэтилена в поли (хлорэтен).
В случае этена при использовании свободнорадикального процесса полученный полимер имеет более низкую плотность и более низкую температуру размягчения, чем поли (этен), полученный с использованием катализатора Циглера-Натта или оксида металла. Поли (этен) низкой плотности, LDPE, имеет боковые цепи, потому что радикалы реагируют не только с молекулами этена путем присоединения, но также и с молекулами полимера посредством процесса, известного как отвод водорода.Полимерный радикал также может отщеплять атом водорода от собственной цепи:
Обе эти реакции приводят к появлению боковых цепей, так что молекулы полимера не могут упаковать друг друга обычным образом. Таким образом, полимер имеет более низкую температуру плавления и более низкую плотность.
Таким образом, полимер имеет более низкую температуру плавления и более низкую плотность.
Таблица 4 Примеры полимеров, полученных с использованием свободнорадикальной полимеризации
Ждем вперед
Поиск катализаторов по-прежнему будет одним из важнейших приоритетов для химической промышленности, поскольку она направлена на проведение процессов при как можно более низкой температуре и как можно более близком к атмосферному давлению, соизмеримых с разумной скоростью реакции.
Выгоды от улучшения катализаторов являются как финансовыми, так и экологическими, что приводит к снижению затрат на топливо, например, при производстве метанола, и сокращении вредных отходящих газов, например, при производстве этановой кислоты. Аналогичным образом бензол и пропен превращаются в кумол при производстве фенола с использованием цеолитного катализатора вместо хлорида алюминия. Это означает, что используются более низкие температуры и давления, а производимые сточные воды намного чище.
Кроме того, ищутся катализаторы, которые будут отдавать предпочтение одной конкретной реакции по сравнению с другой, что снова делает процесс намного более экономичным.Есть преимущества, если можно использовать катализатор, а не другое химическое вещество, которое принимает стехиометрическое участие в реакции и не может быть восстановлено и повторно использовано. Например, хлорид алюминия в течение многих лет использовался для осуществления реакции между бензолом и длинноцепочечным алкеном при производстве алкилбензолсульфонатов, активного поверхностно-активного вещества во многих моющих средствах. Хлорид алюминия нельзя было переработать, и он превратился в отходы в виде гидроксида и оксида алюминия. Теперь используется твердый цеолитный катализатор с кислотными группами, который можно использовать снова и снова без отходов.
Другой аналогичный пример — производство одного из наиболее важных полимеров, используемых для изготовления тканей, полиамида 6 (иногда известного как нейлон 6). В этом процессе циклогексанон превращается в капролактам через оксим (образуемый реакцией кетона с гидросульфатом гидроксиламина). Оксим изомеризуется серной кислотой до капролактама, а сульфат аммония образуется как побочный продукт. Однако теперь снова используется цеолитный катализатор с кислотными центрами для осуществления перегруппировки.Цеолит регенерируется и позволяет избежать использования и последующих отходов серной кислоты.
В этом процессе циклогексанон превращается в капролактам через оксим (образуемый реакцией кетона с гидросульфатом гидроксиламина). Оксим изомеризуется серной кислотой до капролактама, а сульфат аммония образуется как побочный продукт. Однако теперь снова используется цеолитный катализатор с кислотными центрами для осуществления перегруппировки.Цеолит регенерируется и позволяет избежать использования и последующих отходов серной кислоты.
Дата последнего изменения: 10 мая 2013 г.
Наука стала проще: что такое катализаторы?
Автор: Министерство энергетики США. 18 мая 2021 г.
Настоящий катализатор (фоновое изображение) и схема каталитической стадии (изображение переднего плана). Реагирующие молекулы (слева) приобретают энергию, чтобы преодолевать энергетический барьер и превращаться в молекулы продукта (справа). Предоставлено: Изображение любезно предоставлено Аргоннской национальной лабораторией
. Катализатор — это вещество, которое ускоряет химическую реакцию или снижает температуру или давление, необходимые для ее начала, но при этом само не расходуется во время реакции. Катализ — это процесс добавления катализатора для облегчения реакции.
Катализ — это процесс добавления катализатора для облегчения реакции.
Во время химической реакции связи между атомами в молекулах разрываются, перестраиваются и восстанавливаются, рекомбинируя атомы в новые молекулы. Катализаторы делают этот процесс более эффективным за счет снижения энергии активации, которая представляет собой энергетический барьер, который необходимо преодолеть для протекания химической реакции. В результате катализаторы облегчают атомам разрыв и образование химических связей для образования новых комбинаций и новых веществ.
Использование катализаторов приводит к более быстрым и энергоэффективным химическим реакциям. Катализаторы также обладают ключевым свойством, называемым селективностью, с помощью которого они могут направлять реакцию для увеличения количества желаемого продукта и уменьшения количества нежелательных побочных продуктов. Они могут производить совершенно новые материалы с совершенно новыми возможностями использования.
За последние несколько десятилетий ученые разработали все более специализированные катализаторы для важных реальных приложений. В частности, мощные катализаторы изменили химическую промышленность.Эти достижения привели к появлению биоразлагаемых пластиков, новых фармацевтических препаратов, а также экологически безопасных видов топлива и удобрений.
В частности, мощные катализаторы изменили химическую промышленность.Эти достижения привели к появлению биоразлагаемых пластиков, новых фармацевтических препаратов, а также экологически безопасных видов топлива и удобрений.
Быстрые факты
- Люди используют катализаторы тысячи лет. Например, дрожжи, которые мы используем для приготовления хлеба, содержат ферменты, которые являются естественными катализаторами, которые способствуют превращению муки в хлеб.
- Нобелевская премия по химии 2005 г. была присуждена трем исследователям (Ив Шовен, Роберт Х. Граббс и Ричард Р. Шрок) за их работу над катализаторами метатезиса.Доктора Граббс и Шрок были частично профинансированы Министерством энергетики на их исследования, получившие Нобелевскую премию. Доктор Шрок продолжает финансироваться Министерством энергетики США.
- Нобелевская премия по химии 2018 г. была присуждена Фрэнсис Х. Арнольд за ее новаторскую работу по управлению эволюцией ферментов для таких безвредных для окружающей среды приложений, как возобновляемые виды топлива.
 Частично она финансируется Министерством энергетики США.
Частично она финансируется Министерством энергетики США. - Посетите аргоннскую национальную лабораторию, чтобы узнать еще семь вещей о катализе, которых вы, возможно, не знали.
Министерство энергетики США: вклад в исследования катализаторов
Программа фундаментальных энергетических наук Министерства энергетики (DOE) активно поддерживает фундаментальные исследования катализаторов.DOE фокусируется на разработке новых катализаторов и использовании катализаторов для контроля химических превращений на молекулярном и субмолекулярном уровнях. Исследования Министерства энергетики делают упор на понимание этих реакций и на то, как сделать их более эффективными и целенаправленными. Главная цель Министерства энергетики — разработать новые концепции катализа и новых катализаторов, чтобы помочь промышленности производить топливо и химические вещества из ископаемого и возобновляемого сырья более эффективно и устойчиво. Это исследование помогает продвигать солнечное топливо, которое компании производят с использованием солнца и обычных химикатов, таких как углекислый газ и азот. Это исследование также создает передовые методы преобразования использованного пластика в новые продукты.
Это исследование также создает передовые методы преобразования использованного пластика в новые продукты.
Catalyst Примеры, типы и функции | Что такое катализатор? — Видео и стенограмма урока
Типы катализаторов
Существует два основных типа катализаторов — гомогенные катализаторы и гетерогенные катализаторы.Эти классификации зависят от того, образует ли катализатор гомогенную (или однородную) смесь с реагентами или гетерогенную смесь (в которой можно легко различить отдельные компоненты). Если смесь гомогенная, говорят, что катализатор принадлежит к той же самой смеси. фаза в качестве реагентов. Давайте подробнее рассмотрим эти типы катализаторов, а также некоторые примеры катализаторов каждого типа.
Гомогенные катализаторы
Гомогенные катализаторы — это катализаторы, которые находятся в той же фазе, что и реагенты, с которыми они взаимодействуют.Это может означать либо то, что катализатор находится в том же состоянии вещества (твердое, жидкое или газообразное), что и реагенты, и хорошо перемешан, либо что он может растворяться в растворе с реагентами.
Хорошо известным примером гомогенного катализатора являются хлорфторуглероды (CFC). CFC — это газы, которые могут катализировать разложение газообразного озона (O3) в газообразный кислород (O2) в атмосфере. Поскольку ХФУ находятся в той же фазе, что и озон, они считаются однородными. Эта реакция катализа имеет большое значение, потому что газообразный озон играет важную роль в защите Земли от вредного ультрафиолетового излучения, и, расщепляя газообразный озон, ХФУ (которые когда-то широко использовались в аэрозолях и холодильниках) могут нанести непоправимый ущерб защитному озону. слой.
Гетерогенные катализаторы
В отличие от гомогенных катализаторов, гетерогенные катализаторы занимают другую фазу по сравнению с реагентами, с которыми они взаимодействуют, поэтому они взаимодействуют с реагентами противоположным образом, а не однородно. Это может включать катализатор в другом состоянии вещества по сравнению с реагентами (например, твердый катализатор для жидких реагентов) или катализатор, который не растворяется в реагентах. Поскольку они не полностью смешиваются с реагентами, их также называют поверхностными катализаторами.
Это может включать катализатор в другом состоянии вещества по сравнению с реагентами (например, твердый катализатор для жидких реагентов) или катализатор, который не растворяется в реагентах. Поскольку они не полностью смешиваются с реагентами, их также называют поверхностными катализаторами.
Одним из важных гетерогенных катализаторов является металлический никель, который часто используется в качестве катализатора для гидрирования двойных углерод-углеродных связей (например, при производстве гидрогенизированных жиров). Например, никелевый катализатор используется для ускорения процесса реакция между растительным маслом и водородом с образованием маргарина (гидрогенизированного жира).
Катализатор: Примеры
Хотя мы уже обсудили несколько примеров каталитических реакций, существует много более важных применений катализаторов в широком спектре биологических, коммерческих , и производственные процессы.Еще несколько примеров катализаторов включают —
- Железо — используемое в качестве катализатора для синтеза аммиака из азота и водорода посредством процесса Габера.

- Цеолиты — обычно используются в качестве катализаторов органических реакций, таких как крекинг нефти и синтез углеводородов.
- Пятиокись ванадия (V2O5) — важный катализатор, используемый при производстве серной кислоты в контактном процессе.
Резюме урока
Катализатор — это вещество, которое может ускорить реакцию, не расходясь в процессе.Термин происходит от греческого слова katalyien , что означает — растворяться. Катализаторы работают, понижая энергию активации — то есть энергетическое состояние, необходимое для начала реакции — за счет образования временных слабых связей с молекулами реагентов. Однако к концу реакции эти связи теряются, и катализатор возвращается в свое исходное состояние, поэтому для катализатора не происходит чистого изменения . Многие хорошо известные примеры катализаторов — это ферменты , , биологические катализаторы, обнаруженные в живых организмах.
В зависимости от фазы , занятой катализатором при смешивании с реагентами, ее можно разделить на два типа.
 [4]
[4] Водород из топлива соединяется с кислородом воздуха.
Водород из топлива соединяется с кислородом воздуха. Доктор Шрок продолжает финансироваться Министерством энергетики США.
Доктор Шрок продолжает финансироваться Министерством энергетики США. В их число входят экспериментаторы, использующие различные
методы изучения атомной структуры катализаторов и теоретики,
которые проверяют и моделируют экспериментальные результаты.
В их число входят экспериментаторы, использующие различные
методы изучения атомной структуры катализаторов и теоретики,
которые проверяют и моделируют экспериментальные результаты.
 Частично она финансируется Министерством энергетики США.
Частично она финансируется Министерством энергетики США.