Из чего состоит катализатор
Состав автомобильных катализаторов — Katalizator1
Каталитические нейтрализаторы – неотъемлемая часть выхлопной системы транспортного средства, необходимая для очистки выхлопов от токсичных компонентов. Фильтрация газов происходит за счет напыления из драгоценных металлов. Благодаря дорогостоящему составу автомобильные катализаторы представляют ценность даже после истечения срока эксплуатации. Поступая во вторичную переработку, они используются в различных отраслях промышленности – от нефтехимии до изготовления ювелирных украшений.
Состав автомобильного катализатора
Внутри стального корпуса устройства расположен металлический или керамический носитель из множества ячеек, покрытых напылением из редкоземельных металлов. Палладий, платина, родий характеризуются высокой стоимостью, поскольку получение этих элементов в природе – трудоемкий процесс, отнимающий у добывающих предприятий массу ресурсов. Драгоценное покрытие обеспечивает фильтрацию выхлопов, окисляя вредные компоненты и преображая:
- Углеводород – в водяной пар.

- Азотные оксиды – в азот.
- Угарный газ – в углекислый.
В результате в воздух выбрасываются вещества, не представляющие угрозы для окружающей среды и здоровья человека.
Обратите внимание, что по мере использование ценное напыление стирается – в среднем, катализаторы подлежат замене после прохождения 100 – 120 тысяч километров. Срок службы изделий зависит от изначального количества драгоценных металлов в составе. Самыми «насыщенными» и качественными считаются запчасти импортного производства, которые изготавливаются в соответствии со строгими экологическими требованиями. В России стандарты экологичности продукции пока не так высоки, поэтому отечественные производители нередко заменяют драгметаллы на более дешевые элементы.
Можно ли извлечь металлы из катализатора в домашних условиях
Самостоятельная добыча драгметаллов из автокатализатора – сложная процедура, требующая практических навыков и знаний. Существует несколько технологий извлечения ценных элементов:
- Выщелачивание с помощью окислителей.

- Использование «царской водки».
- Разогрев металла с последующим фторированием.
- Гальванический метод.
Применение этих способов целесообразно лишь в том случае, если вы работаете с крупной партией катализаторов. В противном случае, стоимость продажи металлов не окупят расходы на их получение. Гораздо проще и удобнее сдать отработанные детали в пункт приема металлоконструкций, где всю работу за вас сделают профессиональные сотрудники – вам останется только дождаться оценки драгметаллов и получить вознаграждение.
Понравилась информация? Поделись с друзьями
Катализатор. Принцип работы, назначение. Удаление или чистка
На протяжении многих лет авто производители создают много усовершенствований в автомобильных двигателях и топливных системах, чтобы идти в ногу со временем и, безусловно, с законами, направленными на улучшение экологической ситуации на фоне выбросов автомобилей. Одно из кардинальных таких усовершенствований произошло в 1975 году с интересным устройством под названием катализатор. По сути работа катализатора заключается в преобразовании вредных веществ в менее вредные выбросы, прежде чем они покинут выхлопную систему автомобиля.
По сути работа катализатора заключается в преобразовании вредных веществ в менее вредные выбросы, прежде чем они покинут выхлопную систему автомобиля.
Устройство и принцип работы каталитического нейтрализатора
В составе выхлопных газов автомобиля содержится довольно много токсичных веществ. Для предотвращения их попадания в атмосферу используется специальное устройство, получившее название «каталитический нейтрализатор» (более известный как «катализатор»). Он устанавливается на автомобилях, оснащенных двигателями внутреннего сгорания, работающих как на бензине, так и на дизельном топливе. Зная принцип работы катализатора, вы сможете понять важность его работы и оценить последствия, которые может вызвать его удаление.
Конструкция и функции катализатора
Нейтрализатор является частью системы выхлопа. Он располагается сразу за выпускным коллектором двигателя. Катализатор состоит из:
- Металлический корпус (монтажный мат), имеющий входной и выходной патрубки.

- Керамический блок (монолит). Представляет собой пористую структуру с множеством ячеек, которые увеличивают площадь соприкосновения выхлопных газов с рабочей поверхностью.
- Каталитический слой — специальное напыление на поверхностях ячеек керамического блока, состоящее из платины, палладия и родия. В последних моделях для напыления иногда используется золото — драгоценный металл, который имеет более низкую стоимость.
- Металлический кожух. Выполняет функции теплоизоляции и защиты катализатора от механических повреждений.
Главная функция каталитического нейтрализатора — это нейтрализация трех основных токсических компонентов отработавших газов, поэтому он получил свое название — трехкомпонентный. Вот эти нейтрализуемые компоненты:
- Окислы азота NOx – компонент смога, причина кислотных дождей, ядовиты для человека.
- Угарный газ СО – смертельно опасен для человека при концентрации в воздухе от 0,1%.
- Углеводороды CH – компонент смога, отдельные соединения канцерогены.

Принцип действия катализатора
На практике трехкомпонентный каталитический нейтрализатор имеет следующий принцип действия:
Выхлопные газы из двигателя попадают внутрь керамических блоков, где проникают в ячейки, полностью заполняя их.
Металлы-катализаторы палладий и платина провоцируют реакцию окисления, в результате которой несгоревшие углеводороды СН преобразуются в водяной пар, а угарный газ СО в углекислый.
Восстановительный металл-катализатор родий преобразует NOx (оксид азота) в обычный безвредный азот. В атмосферу выпускаются очищенные отработавшие газы.
Если в автомобиле установлен дизельный двигатель, то возле катализатора всегда находится сажевый фильтр. Иногда эти два элемента могут быть совмещены в единую конструкцию. Рабочая температура катализатора играет решающую роль в эффективности процесса нейтрализации токсичных компонентов. Реальное преобразование начинается только после достижения 300°С. Идеальной, с точки зрения эффективности и срока службы, считается температура от 400 до 800°С.
Что ценного в катализаторах
К сожалению, ценного там оказалось много. В роли катализаторов пришлось применить благородные металлы, наиболее подходящие для этой цели.
Дошло до того, что самым дешёвым из них оказалось золото, но чаще приходится использовать платину, палладий и родий. Многим известно, что эти элементы существенно дороже всем понятного золота.
Одновременно с применением столь недешёвых компонент потребовалось создать геометрически непростую структуру, обеспечивающую контактирование каталитического вещества со всем объёмом выпускаемого цилиндрами газа. Это мельчайшие керамические или металлические соты, сквозь которые и продувается весь поток выхлопа.
В результате автомобиль приобрёл сложное, массивное и дорогое устройство в виде металлического корпуса, высокотехнологичной начинки, да ещё и обрамлённое контрольными датчиками с двух сторон, непрерывно следящими за его сохранностью и правильной работой.
Экологичность даром не даётся. Да и на этом прогресс не остановился, дальнейшее ужесточение требований законодателей продолжает влиять на появление дополнительных систем очистки выхлопа.
В дизеле
Катализаторы в дизельном двигателе работают гораздо хуже в сокращении выбросов NOx. Одной из причин этого является то, что дизельные двигатели имеют более низкую рабочую температуру, чем бензиновые двигатели, и катализатор в целом в дизельном двигателе работает хуже, поскольку он меньше нагревается. Некоторые из ведущих экспертов экологических авто придумали новую систему, которая помогает бороться с этим. Они используют мочевину в решении этой проблемы: прежде чем оксиды азота уходят в катализатор, их принудительно испаряют и смешивают с выхлопом и затем создают химическую реакцию, которая приведёт к сокращению выбросов NOx. Мочевина, также известная как карбамид, представляет собой органическое соединение, изготовленное из углерода, азота, кислорода и водорода. Мочевина содержится в моче млекопитающих и земноводных. Мочевина реагирует с NOx, производя в результате реакции азот и водяной пар и утилизируя более 90 процентов оксидов азота в выхлопных газах.
Мочевина, также известная как карбамид, представляет собой органическое соединение, изготовленное из углерода, азота, кислорода и водорода. Мочевина содержится в моче млекопитающих и земноводных. Мочевина реагирует с NOx, производя в результате реакции азот и водяной пар и утилизируя более 90 процентов оксидов азота в выхлопных газах.
Виды катализаторов
По своему назначению нейтрализатор может быть двух- или трехкомпонентным.
- В первом случае он выполняет относительно простые функции окисления (дожигания) угарного газа и углеводородов до образования воды и двуокиси углерода.
- Во втором – добавляется сложная способность устройства работать с окислами азота. Особенно много их образуется в современных дизельных и бензиновых моторах, в силу повышения экономичности, которых конструкторам приходится использовать обеднённые и бедные смеси на впуске.
Трёхкомпонентые катализаторы, а именно такие чаще всего применяются, в свою очередь, могут отличаться по конструктивному признаку, изготавливаясь на базе керамических или металлических сотовых изделий.
Керамические относительно дешевле, но не обладают высокой механической прочностью и долговечностью, склонны к растрескиванию и разрушению, не терпят ударов при наезде на препятствия.
Металлические конструктивы обладают достаточной упругостью, поэтому лучше держат внешние и внутренние удары. Внутренние могут возникать при аномальных процессах горения и разрушительно воздействовать на тонкую сотовую начинку, где, как уже упоминалось, обычно нанесены такие непростые вещества, как платина, палладий и родий.
Но даже металл не спасает от предательского попадания на тонкие соты посторонних веществ из двигателя в виде компонент контрафактных рабочих жидкостей, слишком богатой смеси или всевозможных соединений кремния.
Катализаторы отличаются и по способу их установки. Раньше они располагались в виде врезок выхлопной трубы, подобно глушителям и резонаторам. Но оказалось, что так их очень трудно и затратно прогревать до рабочей температуры, при которой начинаются каталитические реакции.
Поэтому сейчас нейтрализаторы ставят непосредственно за выпускным коллектором, максимально близко к точке выхода раскалённых выхлопных газов. Уже не надо долго ждать выхода прибора на режим, меньше загрязняются кислородные датчики и сокращаются расходы топлива на поддержание температуры.
Срок службы катализатора
Средний ресурс катализатора составляет 100 тыс. километров пробега, но при правильной эксплуатации он может исправно функционировать и до 200 тыс. километров. Основные причины раннего износа — неисправность двигателя и качество топлива (топливовоздушной смеси). При наличии обедненной смеси происходит перегрев, а при слишком богатой возникает засорение пористого блока остатками несгоревшего топлива, что препятствует протеканию необходимых химических процессов. Это приводит к тому, что срок службы каталитического нейтрализатора существенно снижается. Еще одной распространенной причиной неисправности керамического катализатора являются механические повреждения (трещины), возникающие при механических воздействиях.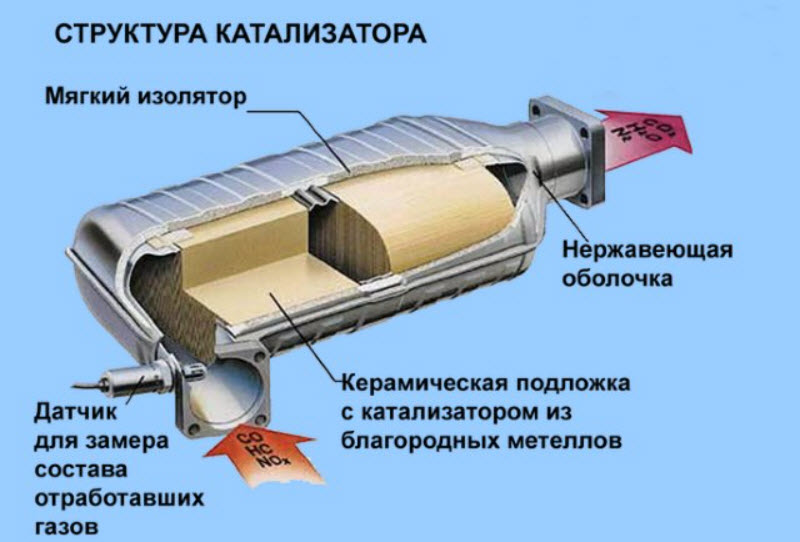 Они провоцируют быстрое разрушение блоков. При возникновении неисправностей работа каталитического нейтрализатора ухудшается, что фиксируется при помощи второго лямбда-зонда. В этом случае электронный блок управления сообщит о неисправности, выдав на приборной панели ошибку «CHECK ENGINE». Также признаками выхода из строя являются дребезжание, увеличение расхода топлива и ухудшение динамики. В этом случае его меняют на новый (оригинального производства или универсальный). Почистить или восстановить катализаторы невозможно, а поскольку это устройство имеет высокую цену, многие автомобилисты предпочитают просто удалить его.
Они провоцируют быстрое разрушение блоков. При возникновении неисправностей работа каталитического нейтрализатора ухудшается, что фиксируется при помощи второго лямбда-зонда. В этом случае электронный блок управления сообщит о неисправности, выдав на приборной панели ошибку «CHECK ENGINE». Также признаками выхода из строя являются дребезжание, увеличение расхода топлива и ухудшение динамики. В этом случае его меняют на новый (оригинального производства или универсальный). Почистить или восстановить катализаторы невозможно, а поскольку это устройство имеет высокую цену, многие автомобилисты предпочитают просто удалить его.
Можно ли удалить катализатор?
При удалении катализатора его очень часто заменяют на пламегаситель. Последний выравнивает поток выхлопных газов. Его установка рекомендуется для устранения неприятных шумов, которые возникают при удалении катализатора. При этом, если вы выбрали именно удаление, лучше полностью снять устройство и не прибегать к рекомендациям некоторых автомобилистов пробить в нем отверстие. Подобная процедура улучшит ситуацию только на время. В автомобилях, соответствующих экологическим стандартам Евро-3, помимо удаления катализатора необходима перепрошивка электронного блока управления. Ее обновляют до версии, в которой отсутствует каталитический нейтрализатор. Также можно установить эмулятор сигнала кислородного датчика, который избавит от необходимости перепрошивать ЭБУ.
Подобная процедура улучшит ситуацию только на время. В автомобилях, соответствующих экологическим стандартам Евро-3, помимо удаления катализатора необходима перепрошивка электронного блока управления. Ее обновляют до версии, в которой отсутствует каталитический нейтрализатор. Также можно установить эмулятор сигнала кислородного датчика, который избавит от необходимости перепрошивать ЭБУ.
Как почистить
В тех случаях, когда соты ещё не повреждены, но пропускная способность нейтрализатора уже снижена смолянистыми отложениями, его можно промыть.
Для этого лучше всего использовать жидкость, обычно применяемую для очистки карбюраторов или топливных форсунок. Только потребуется её значительно больше.
Катализатор заливается промывочной жидкостью, после чего ей предоставляется время на растворение загрязнений, затем её сливают, внутренности детали промываются горячей водой и просушиваются (продуваются).
Обычно процедура требует неоднократного повторения. Существуют также специально предназначенные для подобных промывок составы.
Источники: techautoport.ru, autovogdenie.ru, drive2.ru.
Общая информация о катализаторах
Катализатор — это элемент выхлопной системы. Он выполняет две задачи:
- Окисление выхлопных газов с целью снижения содержания вредных для экологии примесей
- Создание противодавления в выхлопной системе
Устройство катализатора и его разновидности
Существуют три вида катализаторов, разделяющихся по принципу работы:
- Фильтрующий (катализатор дожигания)
- Химический
- Магнитно-стрикционный (МСК)
В данной статье мы рассмотрим самый известный и популярный вид катализатора — катализатор дожигания.
Катализатор дожигания, в свою очередь, делится на два типа:
— Керамический катализатор
— Металлический катализатор
Внутренняя структура катализатора представляет собой соты, выполненные из керамики или металла. По функциональности они идентичны, но катализатор из металла более надежен, тогда как керамические соты довольно хрупки. Стоит металлический катализатор дороже керамического.
Стоит металлический катализатор дороже керамического.
На соты наносится тонкий слой платино-иридиевого сплава, который и обеспечивает окисление выхлопных газов. Платина и иридий – дорогие металлы, отсюда такая высокая стоимость катализатора.
Сам катализатор помещается в корпус из нержавеющей стали.
Принцип работы катализатора
Выхлопные газы представляют собой смесь NO (оксид азота), CH (углеводород), CO (оксид углерода – угарный газ). Эти газы опасны как для окружающей среды, так и для самого человека. Смог, который еще недавно был визитной карточкой больших городов, образуется из-за взаимодействия этих и некоторых других соединений, в результате получается вредная для человека дымовая завеса.
Принцип работы катализатора основан на том, чтобы эти элементы до-окислять путем каталитической реакции между элементами газов и сплава катализатора, в результате на выходе получаются либо более низкие концентрации вредных веществ, либо чистые кислород и углекислый газ.
Реакция происходит из-за высокой температуры выхлопных газов (выше 300 градусов). Чем выше температура, тем быстрее протекает реакция. Температура выхлопных газов во многом зависит от заправляемого топлива. Топливо низкого качества может выдавать очень большую температуру отработанных газов, что уменьшает срок службы катализатора.
Стандарты
Экологическая политика привела к появлению норм содержания вредных веществ в выхлопных газах. В зависимости от конкретного стандарта, топливо и катализаторы разделяются по своему качеству (соответствию стандартам).
На данный момент существует 6 стандартов, принятых в Евросоюзе – Евро-1, Евро-2, Евро-3, Евро-4, Евро-5, Евро-6. Евро-6 ввели в 2013 году, тогда как в России максимальным стандартом на данный момент является Евро-5.
Сейчас в России введен закон на запрет эксплуатации транспортных средств со стандартом ниже Евро-3.
Стандарт Евро-3:
оксид углерода (CO) — не более 2,3г/км (грамм на километр пути)
углеводороды (СН) — не более 0,2 г/км
оксиды азота (NO) — не более 0,15 г/км
Выхлопная система
На современных машинах обычно ставится минимум два катализатора, один из которых ставится прямо на выпускной коллектор (катколлектор).
Для нормальной работы катализатора нужно обеспечить постоянное оптимальное соотношение воздуха и топлива в рабочей смеси, поступающей в камеру сгорания.
Этот параметр (количество кислорода) измеряется датчиком лямбда-зонд, который подает сигнал в блок управления, а тот, в свою очередь, соответствующим образом регулирует подачу топлива в двигатель.
После первого катализатора стоит второй лямбда-зонд, который регистрирует изменение содержания кислорода в выхлопе. Если разницы нет или она ниже допустимого значения, подается сигнал о неисправности катализатора.
После второго лямбда-зонда ставится второй катализатор, который располагается примерно под ногами человека на переднем сидении.
Если установлено 4 катализатора, то два других (нижних) располагаются на некотором отдалении от верхних катализаторов. Если из строя выходит один катализатор, то меняют как минимум два верхних, в противном случае возникает неправильное противодавление.
Из-за чего катализатор выходит из строя
Катализатор это фильтр, а фильтры со временем приходится менять.
Существует несколько причин неисправности катализатора.
1. Истек срок службы. В процесс работы катализатор забивается и превращается в пробку. В таком случае машина начинает «тупить», уменьшается мощность работы. Обычно катализатора хватает на 100-120 тысяч километров пробега. После этого катализатор необходимо менять.
2. Стерся платино-иридиевый слой катализатора. В принципе, забившийся катализатор возможно почистить, однако со временем каталитический сплав стирается и чистка становится абсолютно бесполезным занятием.
3. Керамический слой катализатора разрушился. Это либо вторая стадия после «забивки» катализатора, либо наличие чисто механических повреждений типа ударов. Такое чаще всего происходит у автомобилей, предназначенных для загородной езды. В этом случае частички керамики попадают в двигатель и нарушают его работу. Если это запустить, то можно дойти до капитального ремонта или замены двигателя. Если вы слышите странный треск и дребезжание под ногами, это может говорить в пользу разрушения катализатора.
4. Фильтрующая структура катализатора оплавилась. Это происходит, если температура выхлопных газов превышает допустимый порог. В норме катализаторы выдерживают температуру от 300 до 900 градусов. Причина заключается в некачественном топливе. Оплавленный катализатор так же превращается в пробку.
Как правило, при неисправном катализаторе вы увидите сигнал «Check Engine» или при сканировании – код ошибки P0420. Однако, для точного определения причин проблемы необходимо провести диагностику катализатора.
Что делать и кто виноват
Кто или что несет вину за сломанный катализатор – мы уже узнали выше. Возникает вопрос – что делать дальше?
В первую очередь, необходимо провести диагностику выхлопной системы. Если катализатор вышел из строя, вам предложат его заменить на новый. Вышедший из строя катализатор ремонту не подлежит.
Есть и другой вариант, более дешевый – вы убираете катализатор и ставите на его место пламегаситель. Пламегаситель не фильтрует выхлоп, но зато выполняет вторую функцию катализатора – разбивает поток газов, снижая, тем самым, нагрузку на резонатор. Ставить прямую трубу не рекомендуется — либо катализатор, либо пламегаситель.
Ставить прямую трубу не рекомендуется — либо катализатор, либо пламегаситель.
Если вы решили поставить пламегаситель, то второй лямбда-зонд будет постоянно подавать сигнал ошибки, что довольно сильно раздражает. Но есть способ его обмануть. Здесь либо вам ставят механический контроллер лямбда-зонда, либо программный.
Механический контроллер представляет собой втулку. Втулка вставляется в выхлопную трубу, а лямбда-зонд уже в нее. В таком случае зонд находится на расстоянии от основного потока выхлопных газов и регистрирует норму.
Программный контролер надежнее. Он подает сигнал на бортовой компьютер, соответствующий нормальной работе катализатора.
Штатный или универсальный?
Это второй выбор, с которым вы сталкиваетесь при замене катализатора. Со штатным или оригинальным катализатором все понятно – его продает ваш дилер. Обычно дилер продает катализатор вместе с коллектором, что еще больше увеличивает цену.
Универсальный катализатор намного дешевле, что является очевидным плюсом, т. к. на катализаторы не дают гарантии. Функциональность такая же, как и у штатного, только штатный предназначен специально для марки вашей машины, а универсальный катализатор необходимо подбирать. Здесь большое значение уделяется сервису, который производит замену катализатора.
к. на катализаторы не дают гарантии. Функциональность такая же, как и у штатного, только штатный предназначен специально для марки вашей машины, а универсальный катализатор необходимо подбирать. Здесь большое значение уделяется сервису, который производит замену катализатора.
Кроме того, некоторые автосервисы, например наш автосервис «Глушак», предоставляют гарантию.
Катализатор в автомобиле: что это? из чего состоит? в чем заключается работа?
Автопроизводители создают всё более усовершенствованные автомобили, чтобы соответствовать законам, следящим за экологической ситуацией окружающей среды. Основной прорыв был сделан в 1975 году при создании элементарного устройства — катализатора. Его задача обезвредить вещества до выхода в воздух.
Какие выбросы производит автомобиль?
Бортовой компьютер контролирует объём сгораемого топлива, с целью сохранения пропорций воздух:топливо предельно близкими к стехиометрической точке. В теории, это соотношение дает возможность топливу сгореть полностью без избытка окислителя. В двигателях внутреннего сгорания она равна 14,7:1 — на долю горючего требуется 14,7 долей кислорода. Но на практике, топливная смесь далеко не идеальна.
В теории, это соотношение дает возможность топливу сгореть полностью без избытка окислителя. В двигателях внутреннего сгорания она равна 14,7:1 — на долю горючего требуется 14,7 долей кислорода. Но на практике, топливная смесь далеко не идеальна.
Что такое катализатор в автомобиле?
Катализатор (каталитический нейтрализатор) – часть выхлопной системы, уменьшающий вредные вещества (окись углерода, углеводороды, оксиды азота) в выхлопах.
Автомобильным катализатором называют всю приемную трубу — деталь, сложную и затратную в изготовлении. Состоит из выпускного коллектора, сложных фланцевых соединений, гофры и конечно бочка каталитического преобразователя.
Из чего состоит автомобильный катализатор?
В корпусе располагается керамическая или металлическая конструкция с удлиненными сотами. На сотовую конструкцию наносится тонкий слой сплавов (катализаторов). Она увеличивает площадь контакта проходящих газов с поверхностью каталитического слоя и снижает потребность в веществах, так как используемые элементы дорогие. После бочка катализатора располагается датчик (лямбда-зонд), показывающий загрязненность газов после очистки.
После бочка катализатора располагается датчик (лямбда-зонд), показывающий загрязненность газов после очистки.
%rtb-4%
В чем заключается работа катализатора?
Термин «катализатор» пришёл из химии. Означает вещество, ускоряющее реакцию, не являющееся продуктом реакции. Бывает двух типов: катализатор восстановления, катализатор окисления.
В современных автомобилях используется трёхкомпонентный каталитический преобразователь, уменьшающий количество выбросов 3‐х самых вредных веществ, озвученных ранее.
Первая стадия очистки — катализатор восстановления, снижает количество оксидов азота.
Вторая стадия — катализатор окисления, снижает уровень несгоревших вредных веществ.
Третью стадию выполняет компьютер, контролирующий поток выхлопов и использующая данные для эффективного управления впрыском топлива. Кислородный датчик, установленный ближе к двигателю, передает бортовому компьютеру объем кислорода в выхлопе. Который регулирует пропорцию воздуха к топливу, попадающего в двигатель. Такая модель позволяет удостовериться, что работа двигателя максимально эффективна, и в выхлопной системе остаётся достаточно кислорода для окисления не сгоревших веществ.
Такая модель позволяет удостовериться, что работа двигателя максимально эффективна, и в выхлопной системе остаётся достаточно кислорода для окисления не сгоревших веществ.
Каталитический нейтрализатор работает эффективно, но не достиг идеала. Самый большой недостатком: работа только при высокой температуре. В момент прогрева каталитический преобразователь практически бесполезен. Можно переместить бочку катализатора выше к двигателю, но газы будут более горячими, что приведет к перегреву, а это уменьшит срок работы нейтрализатора. Большинство производителей размещают каталитический преобразователь в районе правого переднего колеса — на достаточном расстоянии от двигателя, с возможностью поддержания необходимой безвредной температуры.
Для сокращения выбросов можно использовать предварительный нагрев каталитического нейтрализатора. Самое элементарное — использовать электрические нагреватели сопротивлений. Но большинство автомобилей (12-вольтные) не нагревают катализатор до необходимой температуры за короткое время. Гибридные автомобили (высоковольтные) справляются с этой задачей очень быстро. Дизельный двигатель работает при низкой температуре, вследствие чего катализатор не продуктивен. В связи с этим, ведущие проектировщики эко-автомобилей изобрели систему, использующую мочевину (карбамид). Мочевина реагируя с оксидом азота, выделяет азот и водяной пар, обезвреживая более 90% оксидов из выхлопа.
Гибридные автомобили (высоковольтные) справляются с этой задачей очень быстро. Дизельный двигатель работает при низкой температуре, вследствие чего катализатор не продуктивен. В связи с этим, ведущие проектировщики эко-автомобилей изобрели систему, использующую мочевину (карбамид). Мочевина реагируя с оксидом азота, выделяет азот и водяной пар, обезвреживая более 90% оксидов из выхлопа.
%rtb-4%
Причины выхода из строя автомобильного катализатора?
Ресурс данной экологической детали велик (100–150 тыс.км). Этого хватит не более чем на 5–7 лет. За это время сотовая конструкция выгорает, и теряет свойство фильтрации выхлопов.
Не маловажная причина – низкокачественное топливо. Некачественный бензин искусственно догоняют до нужного значения октанового числа, добавляя свинцовые добавки. При горении выделяются большие температуры, чем обычном бензине. Катализатор перегревается и оплавляется изнутри, забивая фильтрующие «соты».
Что делать при выходе из строя катализатора?
Менять. Дилеры отказывают в гарантии на эту деталь, объясняя поломку следствием использования некачественного бензина. Оригинальный катализатор стоит очень дорого. В нем содержатся дорогие драгоценные металлы, влияющие на условия растаможивания. Сервисы по ремонту автомобилей предлагают альтернативные варианты катализатору.
Дилеры отказывают в гарантии на эту деталь, объясняя поломку следствием использования некачественного бензина. Оригинальный катализатор стоит очень дорого. В нем содержатся дорогие драгоценные металлы, влияющие на условия растаможивания. Сервисы по ремонту автомобилей предлагают альтернативные варианты катализатору.
- Универсальный катализатор. Непосредственно бочка катализатора. Устанавливается вместо сломанного катализатора.
- Пламегаситель (предварительный резонатор). Ставится вместо катализатора. Выравнивает поток выхлопов (не фильтруя!), устраняя громкие звуки, возникающие в отсутствии катализатора.
Плюсы и минусы аналогов катализатора.
Универсальный катализатор имеет один недостаток: отсутствие гарантии, потому что эксплуатация зависит от внешних факторов. Долговечность у него 60-80 тыс.км, но не редко ломаются раньше, из-за сбоя в системе зажигания или в работе двигателя.
Пламегаситель не фильтрует выхлопные газы, загрязняя атмосферу. Осложняет прохождение техосмотра.
Осложняет прохождение техосмотра.
Для чего нужен лямбда-зонд в автомобиле
Признаки забитого или разрушенного катализатора машины. Методы диагностирования неисправностей катализатора
что в нем ценного и что будет если его убрать
Резкий скачок уровня автомобилизации общества в конце двадцатого века потребовал глобального усиления требований к экологичности двигателей внутреннего сгорания. Суровые законодательные меры вынудили производителей разработать и внедрить сложные технические комплексы очистки выхлопных газов, главными компонентами которых стали системы электронного управления впрыском топлива и специальные узлы дополнительной переработки продуктов выпуска – каталитические нейтрализаторы.
Содержание статьи:
Зачем нужен в машине каталитический нейтрализатор
Большая часть выхлопных газов состоит из вполне нейтральных и безвредных веществ – азота, водяного пара и двуокиси углерода. Но обойтись только их наличием практически невозможно, такое случается лишь в идеально отрегулированном двигателе, работающем в предсказуемом стационарном режиме.
Но обойтись только их наличием практически невозможно, такое случается лишь в идеально отрегулированном двигателе, работающем в предсказуемом стационарном режиме.
Во всех других случаях мотор начинает выделять крайне опасные для человека химически активные вещества, моноокись углерода, углеводороды и окислы азота.
Читайте также: Для чего нужна балансировка колес автомобиля
Прямое уничтожение подобных ядов с большой скоростью и в требуемом объёме практически невозможно, поэтому инженеры были вынуждены прибегнуть к известным из химии каталитическим реакциям переработки вредных веществ в относительно нейтральные.
Катализатором в химии называется компонент реакции, который участвует в процессе, хорошо его ускоряет, но сам при этом не расходуется.
Что ценного в устройстве
К сожалению, ценного там оказалось много. В роли катализаторов пришлось применить благородные металлы, наиболее подходящие для этой цели.
Дошло до того, что самым дешёвым из них оказалось золото, но чаще приходится использовать платину, палладий и родий. Многим известно, что эти элементы существенно дороже всем понятного золота.
Многим известно, что эти элементы существенно дороже всем понятного золота.
Одновременно с применением столь недешёвых компонент потребовалось создать геометрически непростую структуру, обеспечивающую контактирование каталитического вещества со всем объёмом выпускаемого цилиндрами газа. Это мельчайшие керамические или металлические соты, сквозь которые и продувается весь поток выхлопа.
Статья по теме: Установка и подключение кнопки Старт/Стоп с алиэкспресс
В результате автомобиль приобрёл сложное, массивное и дорогое устройство в виде металлического корпуса, высокотехнологичной начинки, да ещё и обрамлённое контрольными датчиками с двух сторон, непрерывно следящими за его сохранностью и правильной работой.
Экологичность даром не даётся. Да и на этом прогресс не остановился, дальнейшее ужесточение требований законодателей продолжает влиять на появление дополнительных систем очистки выхлопа.
Виды катализаторов
По своему назначению нейтрализатор может быть двух- или трехкомпонентным.
- В первом случае он выполняет относительно простые функции окисления (дожигания) угарного газа и углеводородов до образования воды и двуокиси углерода.
- Во втором – добавляется сложная способность устройства работать с окислами азота. Особенно много их образуется в современных дизельных и бензиновых моторах, в силу повышения экономичности, которых конструкторам приходится использовать обеднённые и бедные смеси на впуске.
Трёхкомпонентые катализаторы, а именно такие чаще всего применяются, в свою очередь, могут отличаться по конструктивному признаку, изготавливаясь на базе керамических или металлических сотовых изделий.
Керамические относительно дешевле, но не обладают высокой механической прочностью и долговечностью, склонны к растрескиванию и разрушению, не терпят ударов при наезде на препятствия.
Металлические конструктивы обладают достаточной упругостью, поэтому лучше держат внешние и внутренние удары. Внутренние могут возникать при аномальных процессах горения и разрушительно воздействовать на тонкую сотовую начинку, где, как уже упоминалось, обычно нанесены такие непростые вещества, как платина, палладий и родий.
Но даже металл не спасает от предательского попадания на тонкие соты посторонних веществ из двигателя в виде компонент контрафактных рабочих жидкостей, слишком богатой смеси или всевозможных соединений кремния.
Это интересно: Почему не загорается лампа давления масла при включении зажигания
Катализаторы отличаются и по способу их установки. Раньше они располагались в виде врезок выхлопной трубы, подобно глушителям и резонаторам. Но оказалось, что так их очень трудно и затратно прогревать до рабочей температуры, при которой начинаются каталитические реакции.
Поэтому сейчас нейтрализаторы ставят непосредственно за выпускным коллектором, максимально близко к точке выхода раскалённых выхлопных газов. Уже не надо долго ждать выхода прибора на режим, меньше загрязняются кислородные датчики и сокращаются расходы топлива на поддержание температуры.
Причины и признаки неисправности
Теоретически катализатор должен работать вечно. Благородные металлы не окисляются и не расходуются в химических реакциях каталитического типа. Но реальность выглядит значительно хуже. Тонкие приборы оказываются бессильны перед нарушениями температурного режима и механическими ударами.
Почти все проблемы бывают связаны с нарушением работы систем питания и зажигания двигателя, а также с применением некачественного топлива. Всё это приводит к повышению температуры нейтрализатора, оплавлению и выкрашиванию его сотовой структуры с последующим закупориванием пути свободного прохода выхлопных газов.
При этом катализатор способен нанести страшный ответный удар двигателю. Его близкое расположение к зоне выпускных клапанов привело к опаснейшему эффекту – раскрошенная керамика может попадать в цилиндры.
Его близкое расположение к зоне выпускных клапанов привело к опаснейшему эффекту – раскрошенная керамика может попадать в цилиндры.
Это не является парадоксом, дело в том, что импульсный характер движения газов на выпуске приводит к хаотическому перемещению частиц по коллектору и всасыванию их в двигатель перепадами давления.
Результат известен многим мотористам – царапины и задиры на поверхностях, которым это полностью противопоказано. Двигатель отправляется в капитальный ремонт.
Общим признаком неисправности станет потеря мощности двигателя, его неспособность развить большие обороты. В конце концов он просто перестанет запускаться. Это легко себе представить интуитивно, вообразив, что некто коварно заткнул выхлопную трубу. Результат абсолютно идентичен.
Как проверить
Симптомы слишком характерны, чтобы вызывать сложности с диагностикой забитого катализатора.
Изменившийся звук выхлопа, сдавленное шипение в выпускной системе, иногда вообще крайне слабая реакция руки, подведённой к срезу выхлопной трубы. Обычно к тому же зажигается лампочка контроля состояния двигателя, ЭСУД заметит нештатные показания датчиков.
Обычно к тому же зажигается лампочка контроля состояния двигателя, ЭСУД заметит нештатные показания датчиков.
К сведению: Почему перестал работать парктроник (причины, диагностика, ремонт)
Окончательный диагноз будет поставлен после снятия катализатора с автомобиля. Запечённые, заполненные отложениями и раскрошенные соты невозможно не заметить.
Как почистить
В тех случаях, когда соты ещё не повреждены, но пропускная способность нейтрализатора уже снижена смолянистыми отложениями, его можно промыть.
Для этого лучше всего использовать жидкость, обычно применяемую для очистки карбюраторов или топливных форсунок. Только потребуется её значительно больше.
Катализатор заливается промывочной жидкостью, после чего ей предоставляется время на растворение загрязнений, затем её сливают, внутренности детали промываются горячей водой и просушиваются (продуваются).
Обычно процедура требует неоднократного повторения. Существуют также специально предназначенные для подобных промывок составы.
Существуют также специально предназначенные для подобных промывок составы.
Зачем вырезают катализатор на автомобиле
Подобное удаление имеет негативные последствия в виде увеличения загрязнения окружающей среды.
Выполняется оно обычно по двум причинам – экономии на покупке новой детали, взамен пришедшей в негодность (изделие дорогое по описанным выше причинам) и мощностного тюнинга автомобиля.
Снижение сопротивления на выхлопе позволит мотору раскручиваться более уверенно. К тому не секрет, что экологичность и экономичность пока не могут существовать одновременно. На обслуживание хорошего катализатора требуется значительное количество дополнительного топлива, не несущего полезной нагрузки.
Тонкости удаления устройства из выхлопной системы
Выполнить это без значительных затрат времени иногда невозможно. Прошли времена, когда катализатор представлял собой удобный в обращении жестяной цилиндр с хрупкой керамической начинкой. Два крепких удара ломом — и дело сделано.
Сейчас приходится иметь дело с изделием замысловатой формы, без доступа к внутренностям, да ещё и с крепкими металлическими сотами. Приходится вскрывать корпус и потом его заваривать. В условиях СТО операция не самая дешёвая.
По теме: Почему течет масло из двигателя, как найти и устранить протечку
Завершиться процесс должен перенастройкой «мозгов» двигателя, иначе они сразу вычислят обман. Это делается различными способами, в зависимости от квалификации и привычек исполнителя. Могут применяться как программные, так и аппаратные «обманки» контролирующих датчиков.
Это делается различными способами, в зависимости от квалификации и привычек исполнителя. Могут применяться как программные, так и аппаратные «обманки» контролирующих датчиков.
Результат один – мотор адаптируется к новым условиям и перестаёт паниковать лампочкой «Check engine». Иногда ставят так называемый пламегаситель – специальную вварку, нормализующую звук, температуру и внутреннюю аэродинамику выхлопа.
Какие бывают катализаторы в машине
Большинство неопытных автовладельцев узнают о наличии нейтрализатора только в сервисном центре, когда им сообщают, что эта деталь выхлопной системы неисправна. Однако такие устройства играют очень важную роль в управлении транспортным средством и защите окружающей среды. Сегодня мы расскажем, зачем нужны катализаторы в машине, из чего они состоят и почему так дорого стоят.
Принцип действия автомобильного катализатора
Современные производители регулярно улучшают качество автопродукции, изготавливая запчасти в соответствии с экологическими требованиями. Нейтрализатор, впервые выпущенный в конце 70-х годов прошлого столетия, стал настоящей находкой. Несмотря на простоту конструкции, эта деталь выполняет важнейшую задачу – очищение отработанных выхлопных газов от токсичных компонентов, негативно влияющих на состояние окружающей среды и здоровье человека.
Нейтрализатор, впервые выпущенный в конце 70-х годов прошлого столетия, стал настоящей находкой. Несмотря на простоту конструкции, эта деталь выполняет важнейшую задачу – очищение отработанных выхлопных газов от токсичных компонентов, негативно влияющих на состояние окружающей среды и здоровье человека.
Устройство представляет элемент из металла и керамики, заключенный в прочный стальной корпус, который позволяет избежать преждевременного износа конструкции, защищает нейтрализатор от ударов и перегрева. Внутренний блок имеет ячеистую структуру, обеспечивающую большую площадь соприкосновения выхлопов с рабочей поверхностью. Фильтрация газов выполняется благодаря покрытию из драгоценных металлов, обладающих каталитическими свойствами – ячейки катализатора обработаны тонким слоем родия, палладия и платины. Вступая в контакт с выхлопами, эти элементы преобразуют токсичные азотные оксиды, углеводород и другие вредные вещества в безопасные для живых организмов водяной пар, азот, углекислый газ. Кроме того, драгоценное напыление уменьшает образование мельчайших частиц сажи.
Кроме того, драгоценное напыление уменьшает образование мельчайших частиц сажи.
Что делать, если катализатор в машине сломался
Запчасти рассчитаны на пробег 50 000 – 100 000 километров, однако, как показывает практика, они редко «доживают» до таких показателей. К износу катализатора приводят различные факторы:
- Использование низкокачественного бензина.
- Частая езда на холостом ходу.
- Эксплуатация авто в условиях бездорожья – особенно от ударов и тряски «страдают» хрупкие керамические изделия.
- Попадание масел, антифриза и других жидкостей в камеру сгорания.
- Проблемы с мотором.
Даже после выхода из строя автокатализаторы не теряют ценности – отработанные изделия можно выгодно продать в пункт приема металлолома. Дело в том, что родий, платина и палладий относятся к группе редкоземельных металлов, которые практически не встречаются в природе в чистом виде. Сейчас основным источником этих дорогостоящих элементов служат нейтрализаторы. Особенно высоко оцениваются платиносодержащие детали, которые чаще всего устанавливаются на иномарках премиум-класса и автомобилях с дизельным двигателем.
Особенно высоко оцениваются платиносодержащие детали, которые чаще всего устанавливаются на иномарках премиум-класса и автомобилях с дизельным двигателем.
Понравилась информация? Поделись с друзьями
видов катализа
Катализатор находится в той же фазе, что и реагенты. Обычно все присутствует в виде газа или содержится в одной жидкой фазе. Примеры содержат по одному из них. . .
Примеры гомогенного катализа
Реакция между персульфат-ионами и иодид-ионами
Это реакция раствора, которую вы можете встретить только в контексте катализа, но это прекрасный пример!
Персульфат-ионы (пероксодисульфат-ионы), S 2 O 8 2- , являются очень сильными окислителями.Иодид-ионы очень легко окисляются до йода. И все же реакция между ними в растворе в воде очень медленная.
Если вы посмотрите на уравнение, легко понять, почему это так:
Для реакции требуется столкновение двух отрицательных ионов. Этому серьезно помешает отталкивание!
Этому серьезно помешает отталкивание!
Катализированная реакция полностью устраняет эту проблему. Катализатором могут быть ионы железа (II) или железа (III), которые добавляются в один и тот же раствор.Это еще один хороший пример использования соединений переходных металлов в качестве катализаторов из-за их способности изменять степень окисления.
Для аргументации в качестве катализатора примем ионы железа (II). Как вы вскоре увидите, на самом деле не имеет значения, используете ли вы ионы железа (II) или железа (III).
Ионы персульфата окисляют ионы железа (II) до ионов железа (III). В процессе ионы персульфата восстанавливаются до ионов сульфата.
Ионы железа (III) являются достаточно сильными окислителями, чтобы окислять иодид-ионы до йода.В процессе они снова восстанавливаются до ионов железа (II).
Обе эти отдельные стадии в общей реакции включают столкновение между положительными и отрицательными ионами. Это будет гораздо более успешным, чем столкновение двух отрицательных ионов в некаталитической реакции.
Что произойдет, если в качестве катализатора использовать ионы железа (III) вместо ионов железа (II)? Просто реакции происходят в другом порядке.
Разрушение атмосферного озона
Это хороший пример гомогенного катализа, где все присутствует в виде газа.
Озон, O 3 , постоянно образуется и снова распадается в высоких слоях атмосферы под действием ультрафиолетового света. Обычные молекулы кислорода поглощают ультрафиолетовый свет и распадаются на отдельные атомы кислорода. Они имеют неспаренные электроны и известны как свободные радикалы . Они очень реактивны.
Кислородные радикалы могут затем соединяться с обычными молекулами кислорода с образованием озона.
Озон также можно снова разделить на обычный кислород и кислородный радикал, поглощая ультрафиолетовый свет.
Это образование и разрушение озона происходит постоянно. Взятые вместе, эти реакции останавливают большое количество вредного ультрафиолетового излучения, проникающего в атмосферу и достигающего поверхности Земли.
Каталитическая реакция, в которой мы заинтересованы, разрушает озон и, таким образом, останавливает его поглощение ультрафиолетового излучения.
Хлорфторуглероды (CFC), такие как CF 2 Cl 2 , например, широко использовались в аэрозолях и в качестве хладагентов.При их медленном распаде в атмосфере образуются атомы хлора — свободные радикалы хлора. Они катализируют разрушение озона.
Это происходит в два этапа. В первом случае озон расщепляется и образуется новый свободный радикал.
Катализатор на основе хлор-радикала регенерируется второй реакцией. Это может происходить двумя способами в зависимости от того, попадает ли радикал ClO в молекулу озона или радикал кислорода.
Если он попадает в кислородный радикал (полученный в результате одной из реакций, которые мы рассмотрели ранее):
Или, если он попадает в молекулу озона:
Поскольку радикал хлора продолжает регенерироваться, каждый из них может разрушить тысячи молекул озона.
Что такое катализатор? (с иллюстрациями)
Катализатор — это любое вещество, которое ускоряет химическую реакцию. Он может быть органическим, синтетическим или металлическим. Процесс, посредством которого это вещество ускоряет или замедляет реакцию, называется катализом.
Ученые часто добавляют катализатор в химический раствор, чтобы вызвать реакцию.Для любого процесса требуется энергия, известная как энергия активации. Без помощи катализатора количество энергии, необходимое для разжигания конкретной реакции, велико. Когда он присутствует, энергия активации снижается, благодаря чему реакция протекает более эффективно. Вещество обычно работает либо путем изменения структуры молекулы, либо путем связывания с молекулами реагентов, заставляя их объединяться, реагировать и выделять продукт или энергию. Например, для соединения газов кислорода и водорода с образованием воды требуется катализатор.
Катализаторы важны как в лаборатории, так и на производстве и в промышленности.
Без помощи катализатора химические реакции могут никогда не произойти или на их прохождение потребуется значительно больше времени.Когда происходит химическая реакция, сам катализатор не изменяется и не является частью конечного результата. В большинстве случаев его можно многократно использовать в последующих реакциях.
Иногда вместо ускорения реакции катализатор замедляет реакцию, которая обычно не происходит или происходит очень медленно.Этот тип вещества является отрицательным катализатором, который также называют ингибитором. Ингибиторы важны в медицине, где они имеют решающее значение при лечении психических заболеваний, высокого кровяного давления, рака и множества других проблем со здоровьем.
Катализатор используется в двух типах условий: химических или биохимических.Наиболее часто в биохимических реакциях используются ферменты. Ферменты — это узкоспециализированные белки, которые ускоряют определенные химические реакции. Они делают жизнь возможной. Например, фермент, содержащийся в слюне, при контакте расщепляет пищу для переваривания. Без этого человеку потребовались бы недели, чтобы переварить нашу пищу.
Без этого человеку потребовались бы недели, чтобы переварить нашу пищу.
также важны в лабораторных условиях, а также в производстве и промышленности.Одним из самых известных является каталитический нейтрализатор, который помогает предотвратить выбросы выхлопных газов в атмосферу и снизить расход топлива. Удобрения также являются катализаторами, ускоряющими рост растений.
Катализаторы ускоряют химическую реакцию. .Что это? Зачем мне нужен катализатор на машине?
В современных автомобилях есть одна деталь, которая уже много лет является причиной очень жарких баталий автомобилистов. Но в этих спорах сложно понять аргументы каждой из сторон. Одна часть автолюбителей «за», а другая «против». Эта деталь представляет собой каталитический нейтрализатор. Зачем нужен катализатор, что так важно в дизайне автомобиля, почему об этом постоянно спорят? Попробуем разобраться в этом.
Каталитический нейтрализатор
Эта деталь имеет простую конструкцию, но роль, которую она играет в автомобиле, очень большая и серьезная. Работа любого двигателя внутреннего сгорания сопровождается выбросом множества самых разных и очень вредных веществ (все эти вещества и токсичные газы через выходную магистраль автомобиля выбрасываются прямо в атмосферу). Нейтрализатор позволяет значительно снизить уровень токсичности выбросов, улучшая тем самым экологическую обстановку.
Работа любого двигателя внутреннего сгорания сопровождается выбросом множества самых разных и очень вредных веществ (все эти вещества и токсичные газы через выходную магистраль автомобиля выбрасываются прямо в атмосферу). Нейтрализатор позволяет значительно снизить уровень токсичности выбросов, улучшая тем самым экологическую обстановку.
Так, с помощью специальных химических реакций особо токсичные вещества, не лучшим образом влияющие на состояние атмосферы, превращаются в менее токсичные газы, которые затем выводятся через выхлопную трубу.
В выхлопной системе, кроме нейтрализатора, работают еще и кислородные датчики. Они контролируют качество топливной смеси и влияют на работу каталитического нейтрализатора. Найти это устройство можно в выхлопном тракте между глушителем и двигателем. Устройство дополнительно защищено металлическим экраном, так как во время работы устройство нагревается. Посмотрите, как выглядит катализатор — его фото размещено ниже.
История создания
В 60-е годы в правительстве всех развитых стран мира обратили внимание на уровень экологии и обеспокоили количеством выбросов из выхлопных труб многочисленных автомобилей. И надо сказать, что тогда закон не регулировал уровни выбросов.
И надо сказать, что тогда закон не регулировал уровни выбросов.
В 1970 году были приняты самые первые стандарты, на которые обратило внимание руководство автомобильных концернов. В этих стандартах приведен перечень указаний содержания и количества особо опасных веществ в выхлопных токсичных газах.
В этом стандарте указано, что в новых автомобилях обязательно используется катализатор, что такое устройство позволит значительно снизить количество окиси углерода и продуктов сгорания углеводородов.
С 1975 года все выпускаемые автомобили оснащены катализаторами. Эта деталь стала обязательной.
Устройство и принцип работы
Часто это устройство устанавливают после выходного патрубка двигателя или его можно закрепить непосредственно на фланце выпускного коллектора.
Устройство состоит из специальной несущей конструкции, металлического корпуса и теплоизоляционных материалов.
Среда состоит из ряда ячеек, похожих на пчелиные соты. Он выполняет практически всю работу в устройстве. Эти соты имеют специальное покрытие — рабочий состав. Интересно, что деталь начинает работать не сразу, а только после повышения температуры в выхлопном тракте до 200-300 градусов.
Эти соты имеют специальное покрытие — рабочий состав. Интересно, что деталь начинает работать не сразу, а только после повышения температуры в выхлопном тракте до 200-300 градусов.
Нейтрализатор сжигает окись углерода, которая содержится в продуктах сгорания топлива, а также углеводороды. Есть и другие вещества, нейтрализующие катализатор. Что это за вещества? Это NOx. Газ очень токсичен и вреден. Он разрушает слизистые оболочки человека.
Ячейки нейтрализатора покрыты очень тонкой пленкой на основе уникального сплава платины и иридия. Те остатки токсичных веществ, которые не сгорели в двигателе, при прикосновении к горячей поверхности маленьких ячеек моментально выгорают. Для этого процесса катализатор забирает остаток кислорода, который остается в уже использованных токсичных газах. В результате в этой части выхлопной трубы больше нет токсичных веществ.
Виды
Картриджи с катализаторами могут быть изготовлены из керамических материалов или из металла. Среди автомобилистов более распространена и популярна керамика. Они отлично выдерживают высокие температуры, не подвержены коррозии. Среди плюсов — невысокая цена на такой катализатор (специалисты знают, что такое вещество, как керамика, имеет невысокую стоимость).
Среди автомобилистов более распространена и популярна керамика. Они отлично выдерживают высокие температуры, не подвержены коррозии. Среди плюсов — невысокая цена на такой катализатор (специалисты знают, что такое вещество, как керамика, имеет невысокую стоимость).
Есть еще минус керамический катализатор. В этом его хрупкость. Деталь абсолютно неустойчива к любым механическим повреждениям, а поскольку устройство находится под днищем станка, велика вероятность встретить устройство бордюром, камнем, чем-либо.Тогда деталь сломается. Аналоги из металла намного прочнее, но цена их очень высока за счет сплава платины. Например, катализатор ВАЗ при поломке не ремонтируют, и многие не покупают новый из-за дороговизны.
Катализаторы на разные марки автомобилей
Автомобили в зависимости от производителя могут существенно различаться. То же самое и с нейтрализаторами. Они также различаются от модели к модели. Мы рассмотрим самые популярные марки автомобилей.
ВАЗ
Катализатор на ВАЗах ничем особенным не отличается. Все они металлические, часто выходят из строя из-за различных повреждений. Найти устройство в машине можно под днищем, возле выхлопной трубы двигателя. Часто при выходе из строя ремонт катализатора невозможен.
Все они металлические, часто выходят из строя из-за различных повреждений. Найти устройство в машине можно под днищем, возле выхлопной трубы двигателя. Часто при выходе из строя ремонт катализатора невозможен.
Ford
В отличие от отечественных автопроизводителей компания Ford позаботилась о водителях. Таким образом, устройство обезвреживания токсичных газов в машинах этой марки выполнено на основе керамики.
Для регулирования количества кислорода в приборе, интегрированном в компьютер, используется лямбда-зонд для качественной химической реакции.
Таким образом, катализатор «Фокуса» состоит из одного каталитического коллектора и двух датчиков. У мощных двигателей есть два коллектора, а также четыре датчика. Последние можно найти как до, так и после устройства. Управлять нейтрализатором можно с панели приборов.
Устройство рассчитано на 120 тысяч километров пробега. Если использовать с двигателем некачественное топливо, эта деталь может выйти из строя намного быстрее. В случае поломки отремонтировать катализатор «Форд» невозможно. В этом случае выполняется только замена.
В случае поломки отремонтировать катализатор «Форд» невозможно. В этом случае выполняется только замена.
Проверить работоспособность можно очень просто, но понять необходимость замены тоже несложно. При неработающем катализаторе существенно падают силовые характеристики. Чтобы проверить работу устройства, необходимо провести замеры вредных веществ в выхлопе машины. Если фильтры забиты, то уровень вредных токсинов зашкалит.
Также это можно проверить, сняв датчик, установленный перед нейтрализатором.
Затем с помощью специального переходника необходимо подключить манометр и произвести замеры давления при различных нагрузках двигателя. Даже если устройство вышло из строя, ремонт катализатора невозможен.Если катализатор «Форд» забился, в этом случае снимаем старый прибор, а на его место устанавливаем новый с повышенными стандартами. Также возможна замена катализатора на пламегаситель или универсальный нейтрализатор.
Тойота ускоритель
«Тойота» в этом выпуске тоже ничем примечательным не отличается. Это такие же соты с золочением или платино-иридиевым сплавом. В новых автомобилях этой марки таких устройств три — они соединены между собой последовательно. Каждый из них предназначен для очистки газов от одного вида вредных веществ.
Это такие же соты с золочением или платино-иридиевым сплавом. В новых автомобилях этой марки таких устройств три — они соединены между собой последовательно. Каждый из них предназначен для очистки газов от одного вида вредных веществ.
Правильная работа катализатора
Чтобы сохранить прибор как можно дольше в экологической ситуации, необходимо правильно им пользоваться. Итак, первая и самая главная рекомендация, которая продлит срок эксплуатации оборудования, — это качественное топливо известных и популярных брендов.Некачественное топливо может содержать вещества, которые легко разрушают распыление сот. Особенно плохо для катализатора («Калина» не исключение) такой металл, как тетросигник. Это вещество давно запрещено во многих развитых странах.
Также необходимо помнить, что нейтрализатор срабатывает под воздействием очень высоких температур, поэтому не паркуйте автомобиль в местах, где валяются легковоспламеняющиеся предметы, листья, бумага или что-то еще.
Водителю, если он хочет спасти катализатор, не следует часто включать стартер, если машина не заводится.
Лучше поставить на паузу. Также не следует проворачивать коленчатый вал, отсоединяя свечи зажигания. Не запускайте двигатель также буксиром.
Как понять, что он сломался
Если, например, на машине установлен катализатор (Шевроле Авео в том числе) и нужно понимать, работает он или нет, для этого есть несколько способов.
Когда машина работает нормально, то ни при каких условиях лампа на панели приборов, сообщающая о проблеме с катализатором, не загорается.
.Определение катализатора — Химический словарь
Что такое катализатор?
Катализатор — это вещество, которое ускоряет химическую реакцию, но не расходуется в ходе реакции; следовательно, катализатор может быть восстановлен химически без изменений в конце реакции, которую он использовал для ускорения, или катализатор , катализирующий .
Обсуждение
Чтобы химические вещества вступили в реакцию, их связи должны быть перегруппированы, потому что связи в продуктах отличаются от связей в реагентах. Самый медленный шаг в перегруппировке связи приводит к так называемому переходному состоянию. — химическое соединение, которое не является ни реагентом, ни продуктом, но является промежуточным звеном между ними.
Самый медленный шаг в перегруппировке связи приводит к так называемому переходному состоянию. — химическое соединение, которое не является ни реагентом, ни продуктом, но является промежуточным звеном между ними.
Реагент ⇄ Переходное состояние ⇄ Продукт
Для формирования переходного состояния требуется энергия. Эта энергия называется энергией активации или E a . Чтение приведенной ниже диаграммы слева направо показывает развитие реакции, когда реагенты проходят переходное состояние и становятся продуктами.
Преодолевая барьер
Энергию активации можно рассматривать как барьер для химической реакции, барьер, который необходимо преодолеть. Если барьер высокий, немногие молекулы обладают достаточной кинетической энергией, чтобы столкнуться, сформировать переходное состояние и пересечь барьер. Реагенты с энергией ниже E a не могут пройти через переходное состояние, чтобы вступить в реакцию и стать продуктами.
Катализатор работает, обеспечивая другой путь реакции с более низким E — .Катализаторы снижают энергетический барьер. Другой путь позволяет упростить перегруппировку связей, необходимую для превращения реагентов в продукты, с меньшим потреблением энергии. В любой заданный интервал времени присутствие катализатора позволяет большей части реагентов набрать достаточно энергии, чтобы пройти через переходное состояние и стать продуктами.
Пример 1. Процесс Габера
Процесс Габера, который используется для получения аммиака из водорода и азота, катализируется железом, которое обеспечивает атомные центры, на которых связи реагентов могут легче перестраиваться с образованием переходного состояния.
N 2 (газ) + 3H 2 (газ) ⇌ 2NH 3 (газ)
Пример 2: Ферменты
В нашем организме и в других живых существах ферменты используются для ускорения биохимических реакций. Фермент — это разновидность катализатора. Сложная жизнь была бы невозможна без ферментов, позволяющих протекать реакциям с подходящей скоростью. Формы ферментов вместе с местами на ферменте, которые связываются с реагентами, обеспечивают альтернативный путь реакции, позволяя конкретным молекулам объединяться для образования переходного состояния с пониженным энергетическим барьером активации.
Сложная жизнь была бы невозможна без ферментов, позволяющих протекать реакциям с подходящей скоростью. Формы ферментов вместе с местами на ферменте, которые связываются с реагентами, обеспечивают альтернативный путь реакции, позволяя конкретным молекулам объединяться для образования переходного состояния с пониженным энергетическим барьером активации.
На схеме ниже длинноцепочечный фермент обеспечивает места для молекул реагентов, которые собираются вместе для образования переходного состояния с низкой энергией активации.
Катализаторы не могут изменить положение химического равновесия — прямая и обратная реакции ускоряются, так что константа равновесия K eq остается неизменной. Однако, удаляя продукты из реакционной смеси по мере их образования, на практике можно увеличить общую скорость образования продукта.
.Что означает катализатор?
КАТАЛИЗАТОР
Вы можете описать человека или вещь, которая вызывает изменение или событие, как катализатор. Вещество, которое позволяет химической реакции протекать обычно с большей скоростью или в других условиях (например, при более низкой температуре), чем иначе возможно; человек или вещь, которая ускоряет событие или изменение; что-то, что заставляет химическую реакцию происходить быстрее без изменения самой себя; событие или человек, вызывающие большие изменения; человек, чьи разговоры, энтузиазм или энергия заставляют других быть более дружелюбными, восторженными или энергичными; агент, который провоцирует или ускоряет существенное изменение или действие; кто-то или что-то, что заставляет что-то произойти или измениться; Причины, причина, источник.
Их цель должна состоять в том, чтобы показать к 2021 году, когда они собрались, чтобы подвести итоги прогресса, достигнутого после Парижского соглашения и обязуются повысить свою игру, чтобы пандемия стал катализатором прорыва в окружающей среде.
(Отправлено анонимом 22 июня 2020 г.) .Химики случайно открыли способ превратить углекислый газ в этанол
Превращение загрязнения в ТОПЛИВО: химики случайно открывают способ превращения диоксида углерода в этанол
- Катализатор состоит из частиц меди, заключенных в углеродные штыри
- При подаче напряжения катализатор запускает сложную химическую реакцию
- Он преобразует диоксид углерода в воде непосредственно в этанол
- Его можно использовать для хранения избыточной электроэнергии от ветра и солнечной энергии
Автор: Shivali Best For Mailonline
Опубликовано: | Обновлено:
В прошлом году почти 38.2 миллиарда тонн углекислого газа было выброшено в воздух в результате сжигания ископаемого топлива, такого как уголь и нефть.
Но ученые придумали способ превратить газ в более полезный продукт — этанол.
Исследователи случайно наткнулись на простую реакцию, но если бы процесс можно было довести до промышленных масштабов, это могло бы помочь уменьшить последствия глобального потепления.
Прокрутите вниз, чтобы увидеть видео
В прошлом году почти 38,2 миллиарда тонн углекислого газа было выброшено в воздух в результате сжигания ископаемого топлива, такого как уголь и нефть (стоковое изображение).Но ученые, возможно, придумали способ превратить газ в более полезный продукт — этанол
КАТАЛИЗАТОР
Исследователи создали катализатор — вещество, которое увеличивает скорость химической реакции — из углерода, меди и азота. .
Когда было приложено напряжение, катализатор вызвал сложную химическую реакцию, которая, по сути, полностью изменила процесс горения.
С помощью катализатора раствор диоксида углерода в воде превратился в этанол с выходом 63%.
Без катализатора реакция этого типа обычно приводит к смешению нескольких различных продуктов в небольших количествах.
Что делает новый катализатор уникальным, так это его наноразмерная структура, состоящая из частиц меди, заключенных в углеродные иглы.
Эта новая текстура позволяет избежать использования дорогих или редких металлов и сделать масштабирование катализатора реальной целью.
Ученые из Национальной лаборатории Ок-Ридж при Министерстве энергетики разработали электрохимический процесс, в котором используются крошечные шипы углерода и меди для превращения двуокиси углерода, парникового газа, в этанол.
Доктор Адам Рондиноне, ведущий автор исследования, сказал: «Мы случайно обнаружили, что этот материал работает.
«Мы пытались изучить первую стадию предложенной реакции, когда мы поняли, что катализатор выполняет всю реакцию самостоятельно».
«Вы можете использовать его [этанол] в существующем автопарке прямо сейчас, без изменений», — добавил он.
Исследователи создали катализатор — вещество, которое увеличивает скорость химической реакции — из углерода, меди и азота.
Когда было приложено напряжение, катализатор вызвал сложную химическую реакцию, которая, по сути, полностью изменила процесс горения.
С помощью катализатора раствор диоксида углерода в воде превратился в этанол с выходом 63%.
Без катализатора реакция этого типа обычно приводит к смешению нескольких различных продуктов в небольших количествах.
Д-р Рондиноне сказал: «Мы берем углекислый газ, побочный продукт сгорания, и с очень высокой селективностью отодвигаем эту реакцию горения в обратном направлении в пользу полезного топлива.
«Этанол стал неожиданностью — чрезвычайно сложно сразу перейти от диоксида углерода к этанолу с одним катализатором».
Что делает новый катализатор уникальным, так это его наноразмерная структура, состоящая из частиц меди, заключенных в углеродные иглы.
Что делает новый катализатор уникальным, так это его наноразмерная структура, состоящая из частиц меди, встроенных в углеродные иглы. Эта новая текстура позволяет избежать использования дорогих или редких металлов и сделает масштабирование катализатора реалистичной целью.
Эта новая текстура позволяет избежать использования дорогих или редких металлов и сделает масштабирование катализатора реальной задачей.
Доктор Рондиноне сказал: «Используя обычные материалы, но используя нанотехнологии, мы выяснили, как ограничить побочные реакции и в итоге получить то, что нам нужно».
Комбинация недорогих материалов и возможность использовать катализатор при комнатной температуре в воде означает, что этот подход может быть расширен для промышленных применений.
Теперь исследователи планируют усовершенствовать свой подход для повышения общей производительности и дальнейшего изучения свойств и поведения катализатора.
Например, этот процесс можно использовать для хранения избыточной электроэнергии, вырабатываемой ветровыми и солнечными источниками энергии.
Г-н Рондиноне добавил: «Такой процесс позволит вам потреблять дополнительную электроэнергию, когда ее можно будет производить и хранить в виде этанола.
«Это могло бы помочь сбалансировать сеть, снабжаемую периодически возобновляемыми источниками».
Теперь исследователи планируют усовершенствовать свой подход для повышения общей производительности и дальнейшего изучения свойств и поведения катализатора.
Поделитесь или прокомментируйте эту статью:
.Что представляет собой катализатор универсального типа и его отличия от оригинального
Каталитический нейтрализатор универсального типа – это подходящее для многих моделей автомобилей, обладающих схожей работоспособностью и похожими техническими свойствами, устройство. Можно привести в пример несколько подобных характеристик:
• Объем двигателя машины.
• Мощность двигателя.
• Средний показатель экологических выбросов и др.
В автомобили обычно ставят катализаторы универсального типа, так как по набору функций они чаще всего не имеют отличий от оригинальных.
Классификация моделей по экологическим стандартам выбросов является наиболее востребованной и используемой. Все европейские автомобили, выпущенные с 2005 года, имеют класс Евро 4. Такой же класс присвоен машинам из Кореи и Америки, выпущенным с 2006 года, из России и Японии – с 2010 года, из Китая – с 2012 года. Автомобили этого класса оборудованы катализаторами подходящей марки.
Отличия оригинального катализатора (предустановленного) от универсального
Распространена точка зрения, что установленные на производстве серийные катализаторы значительно отличаются характеристиками от универсальных, на которые их заменяют. Однако подтверждений у таких мыслей нет. Напротив, многие компании, занимающиеся изготовлением каталитических нейтрализаторов, поставляют их как на заводы по серийному производству, так и в розничную продажу автозапчастей. И стоит отметить, что между ними почти нет разницы по таким показателям как:
- долговечность;
- надежность;
- прочность.
Наибольшее воздействие на каталитический нейтрализатор производит состояние мотора и характеристики топлива, используемого для заправки автомобиля.
На те машины, где катализатор и коллектор составляют единый элемент, а также на те, где корпус нейтрализатора выполнен из чугуна, установить универсальную модель не получится. Однако и из этого правила есть исключения: если в корпусе есть свободное место, а коллектор сделан из нержавеющей стали.
Катализатор селективного восстановления оксидов азота АОК-78-55 успешно прошел испытания
Специалистами СКТБ «Катализатор» проведены испытания катализатора селективного восстановления оксидов азота аммиаком марки АОК-78-55 в условиях повышенных температур.
Москва, 28 апр — ИА Neftegaz.RU. Специалистами СКТБ «Катализатор» проведены опытно-промышленные испытания катализатора селективного восстановления оксидов азота аммиаком марки АОК-78-55 в условиях повышенных температур. Результаты испытаний подтвердили лабораторные исследования, что открыло возможность клиентам СКТБ «Катализатор» применять данный катализатор в условиях работы агрегатов АК-72М и, таким образом, снизить эксплуатационные затраты.
Об этом компания сообщает 28 апреля 2018 г.
В промышленных агрегатах получения неконцентрированной азотной кислоты после стадии абсорбции оксидов азота водой сбросовый газ, предварительно подогретый, поступает на реактор каталитической очистки, где в присутствии катализатора идет процесс селективного восстановления оксидов азота до образования безвредных продуктов: азота и воды.
Крупные агрегаты получения азотной кислоты АК-72 используют дорогостоящий катализатор с содержанием благородного металла – палладия, которому требуется высокая температура для его эксплуатации и, соответственно, это отражается на эксплуатационных затратах.
В свою очередь, некоторые агрегаты АК-72 были модернизированы в АК-72М. Модернизация коснулась и реакторов каталитической очистки, где при средних температурах применяются медь-цинковые катализаторы.
Сотрудниками СКТБ «Катализатор» были проанализированы данные о работе катализаторов и условия их эксплуатации, проведены лабораторные исследования физико-химических характеристик и возможности применения алюмованадиевых катализаторов в условиях работы агрегатов АК-72М.
Результат этих исследований подтвердил возможность эксплуатации катализаторов марки АОК-78-55 при сохранении высокой прочности в условиях повышенных температур и нагрузок со следующими степенями очистки:
— 99,36 % — при температуре 350 оС;
— 99,86 % — при температуре 360 оС.
На основе данных о лабораторных исследованиях катализатора марки АОК-78-55 были проведены опытно-промышленные испытания в условиях реального производства, целью которых было определение эффективности очистки выхлопного газа и возможности использования данного катализатора для промышленной эксплуатации в агрегатах АК-72М.
По результатам опытно-промышленных испытаний в опытном реакторе была достигнута степень очистки газа от оксидов азота на уровне 99,3%, что является отличным показателем эффективности при соблюдении норм технологического режима.
Важным критерием промышленного применения алюмованадиевых катализаторов является минимизация так называемой «ванадиевой коррозии», которая возможна при наличии оксида ванадия в составе газа после реактора.
По нашим данным, унос оксидов ванадия с катализатора происходил при использовании алюмованадиевых катализаторов с недостаточной фактической прочностью на истирание, которая достигает у некоторых производителей значения 22,7%. Эти катализаторы в течение эксплуатации теряли прочность и разрушались.
Однако, катализатор марки АОК-78-55 готовится по совершенно другой технологии, обеспечивающей исключительно высокую прочность и термостабильность катализатора при промышленной эксплуатации.
При разработке катализатора АОК-78-55 специалистами СКТБ «Катализатор» упор изначально был сделан на высокую прочность при сохранении высокой каталитической активности, что исключает унос пыли катализатора и риск возникновения ванадиевой коррозии. Многолетний успешный опыт эксплуатации катализатора АОК-78-55 во многих промышленных агрегатах УКЛ-7 подтверждает высокие потребительские качества нашего продукта.
В настоящий момент Дирекция химического инжиниринга СКТБ «Катализатор» готова оперативно помочь предприятиям азотной промышленности в решении задач по переходу на катализатор селективного восстановления оксидов азота марки АОК-78-55, провести все необходимые обследования и расчеты, а также осуществить инжиниринговое сопровождение эксплуатации катализатора.
Прочитать in English
Химики создали катализатор для мгновенной дезинфекции воды — Наука
ТАСС, 1 июля. Химики создали катализатор на базе наночастиц палладия и золота, который может за полминуты очищать воду от болезнетворных микробов и органических загрязнений. Описание разработки опубликовал научный журнал Nature Catalysis.
«Мы реализовали идею, согласно которой можно мгновенно очищать воду, используя лишь катализатор, загрязненную жидкость и электричество. В этом отношении наше изобретение значительно превосходит коммерческие дезинфицирующие средства на основе хлорки или перекиси водорода», – рассказал один из авторов работы, профессор Кардиффского университета Грэм Хатчинс.
По оценкам Всемирной организации здравоохранения, около миллиарда людей на Земле лишены постоянного доступа к чистой питьевой воде, свободной от загрязнений, паразитов и болезнетворных микробов. Еще два миллиарда вынуждены периодически пить загрязненную воду. Кроме того, во многих государствах, расположенных в тропиках и у экватора, доступ к пресной воде сильно ограничен.
Ученые пытаются решить эту проблему по-разному: разрабатывают системы по извлечению влаги из воздуха, очистке морской воды от солей или обеззараживанию жидкости из загрязненных рек и озер. Хатчинс и его коллеги сделали большой шаг в этом направлении. В ходе своего исследования они работали над катализатором, который превращает водород и кислород из воздуха в перекись водорода.
Изначально ученые предполагали, что разработанный ими катализатор можно использовать для производства перекиси водорода прямо при очистке воды. Наблюдения за его работой показали, что в процессе синтеза H2O2 возникает множество других молекул, содержащих кислород, которые в десятки и сотни миллионов раз активнее взаимодействуют с микробами, чем перекись и хлорка.
Столь высокий уровень бактерицидности этих соединений, как отмечают Хатчинс и его коллеги, позволяет проводить практически мгновенную очистку воды от микробов, спор и прочих органических загрязнений, способных негативно повлиять на здоровье человека.
Для этого достаточно погрузить небольшое количество наночастиц катализатора в воду и пропустить через нее ток, в результате чего через 30 секунд все следы микробов полностью исчезнут из воды. Подобная обработка воды предотвращает появление бактериальных пленок и других потенциально опасных скоплений органической материи, которые иногда возникают при очистке воды традиционными методами.
При этом, как отмечают ученые, наночастицы металлов не расходуются и остаются стабильными, что позволяет использовать подобные катализаторы для очистки воды практически неограниченное время. Поэтому Хатчинс и его коллеги надеются, что созданный ими катализатор совершит революцию в обеспечении населения Земли чистой питьевой водой уже в ближайшие годы.
Катализаторы в нефтехимии | Научные открытия и технические новинки из Германии | DW
Помнится, в школе нам говорили о том, что существуют вещества, ускоряющие химические реакции, но сами в них не участвующие и не входящие в состав конечных продуктов, и что эти вещества называются катализаторами. Правда, сегодня слово «катализатор» у большинства населения ассоциируется, как правило, с устройством, расположенным в выхлопной трубе автомобиля и предназначенным для снижения токсичности отработавших газов. Между тем, без катализаторов было бы невозможно само наше существование, потому что чуть ли не все биохимические реакции в живом организме протекают лишь в присутствии ферментов, то есть биологических катализаторов.
Современная промышленность также нуждается в катализаторах: без них производственные процессы в химической и перерабатывающей отраслях либо потребовали бы значительно более высоких энергозатрат, либо вообще были бы невозможны. Особую роль катализаторы играют в нефтехимии. Потребность промышленно развитых государств в нефти постоянно растёт – и не только потому, что она является важнейшим энергоносителем, сырьём для получения реактивного и дизельного топлива, бензина, керосина, мазута и масел. Общий ассортимент нефтепродуктов охватывает около полумиллиона наименований и включает лаки и краски, пластмассы и лекарства. Нефть представляет собой сложную смесь парафиновых, нафтеновых и реже ароматических углеводородов, то есть состоит в основном из длинных тяжёлых молекул. Чтобы получить моторные топлива и химическое сырьё, нефть подвергают переработке, протекающей с распадом этих молекул. Эта операция – она именуется крекингом – происходит при одновременном воздействии на нефть высокой температуры и катализаторов – например, алюмосиликатных. Теперь специалисты Научно-исследовательского института органического катализа в Ростоке разработали технологию, в основе которой – новый катализатор, а конечным продуктом реакции являются амины – соединения, молекулы которых наряду с атомами углерода и водорода содержат и атомы азота. Директор института, профессор Маттиас Беллер (Matthias Beller) поясняет:
В природе амины встречаются в форме аминокислот, а также входят в состав наследственного материала. В технике амины являются исходным сырьём для производства полимерных материалов, например, полиуретана, а также для получения биологически активных веществ, используемых в фармацевтике и агрохимии.
Интерес у ростокских учёных вызывают вполне определённые, относительно простые амины, и этот интерес вполне объясним: сегодня объём их производства значительно превышает миллион тонн в год. Исходным сырьём для получения этого класса веществ служат так называемые этиленовые углеводороды, или олефины, молекулы которой представляют собой «открытую», то есть не замкнутую в кольцо, линейную цепь. Профессор Беллер говорит:
Олефиновые смеси образуются в больших количествах при переработке нефти в крекинговых установках. Эти смеси служат очень важным сырьём для химической промышленности. Причём сначала производится их разделение на отдельные компоненты и фракции, а потом эти компоненты перерабатываются – например, в амины и ряд других органических соединений.
До сих пор непосредственное применение находила лишь часть олефинов – более реакционноспособных. Менее реакционноспособные олефины, – а их образуется ничуть не меньше, – приходилось сперва разделять и очищать путём весьма сложных, энерго- и трудоёмких производственных операций. Именно от этих операций и позволяет отказаться разработанная в Ростоке технология. Она предусматривает совместную переработку в амины всех олефинов сразу.
В нашей технологии в реакцию вступают и менее активные олефиновые компоненты. Они дёшевы, потому что образуются в больших количествах, но до сих пор их не удавалось напрямую преобразовывать в амины.
Разработка учёных Ростокского института позволяет существенно упростить нынешнюю технологию: из трёх производственных операций две оказываются ненужными. Это означает, что то же самое количество аминов можно получать, расходуя втрое меньше времени и энергии, чем сейчас. И всё благодаря новому катализатору. Заявка на патент уже подана, но ещё не рассмотрена, и профессор Беллер явно не готов пока вдаваться в детали, ограничиваясь фразой, что особые свойства катализатору придаёт модификация одного из его компонентов.
Опираясь на наше тесное сотрудничество с нефтеперерабатывающей отраслью, а также используя теоретические расчёты, мы так модифицировали нашу систему катализаторов, что она обеспечила нам строго определённую последовательность протекания всего комплекса реакций.
Многие из этих реакций ранее вообще не были описаны наукой, что вызвало немалый интерес у специалистов во всём мире. Но главное достоинство новой технологии всё же в том, что она позволяет получать амины более экономично и экологично. Сегодня ростокские учёные уже вступили в переговоры с ведущими нефтяными концернами относительно широкого внедрения своего катализатора.
Поиском новых катализаторов занимаются и исследователи Института имени Фрица Хабера в Берлине. Вот уже почти двадцать лет прошло с тех пор, как химики впервые узнали о существовании так называемых фуллеренов – особых кристаллических модификаций углерода, молекулы которых имеют форму полого шара, состоящего из 60-ти, 80-ти, 180-ти, 240-ка или даже 560-ти атомов и своей структурой напоминающего микроскопический футбольный мяч. Позднее были открыты – или синтезированы – молекулы углерода в форме трубок, эллипсоидов, клубков и так далее. Особый интерес к фуллеренам объясняется тем, что среди их производных – сверхпроводники, лекарственные вещества и прочие нужные и полезные вещи. А теперь Роберт Шлёгль (Robert Schlögl), научный сотрудник берлинского института, получил своего рода луковицу из углерода. И тоже с весьма необычными свойствами.
Для подавляющего большинства всё новых и новых веществ, производимых химической промышленностью, исходным сырьём служит от силы дюжина основных химикатов. Один из них – стирол, или винилбензол. Годовой объём мирового производства этой бесцветной жидкости с резким запахом достигает 20 миллионов тонн. Стирол – мономер в производстве полистирола, бутадиен-стирольных каучуков, термоэластопластов и многих других продуктов. Сам стирол получают каталитическим дегидрированием этилбензола. Функцию катализатора выполняют оксиды железа – по крайней мере, так считалось до сих пор. Но теперь Роберт Шлёгль неожиданно обнаружил, что это не так. Оказалось, что реакция идёт лишь в том случае, если оксиды железа покрыты тонким слоем углерода. Более того, присутствие оксидов железа вовсе не обязательно: достаточно одного углерода. Правда, не любого, а его вполне определённой кристаллической модификации. Роберт Шлёгль говорит:
Это алмазная пыль, которая возникает в процессе искусственного получения алмазов из графита посредством взрывной технологии. Существует целый ряд заводов по производству алмазов методом детонационного синтеза – прежде всего, в России. Так вот, при этом образуется чёрное вещество, внешне совсем не похожее на алмаз, однако имеющее его кристаллическую структуру. Можно назвать эту сажу отходом производства синтетических алмазов. Речь идёт о количествах, измеряемых сотнями граммов.
Нагревая эту алмазную сажу, Роберт Шлёгль получает миниатюрные луковицы из углерода. Эти частицы представляют собой сложные структуры, состоящие из множества расположенных в несколько слоёв вогнутых чешуек. Именно здесь берлинский учёный и обнаружил те самые структурные элементы, которые выполняют роль катализатора в производстве стирола:
Среди этих углеродных луковичных чешуек и находится в чистом виде та самая идентифицированная нами в качестве катализатора дефектная структура. То есть максимальная плотность активных центров достигается на этом самом углероде. Это позволяет нам сделать два важных вывода: во-первых, мы теперь смогли убедиться в том, что наша гипотеза о химической природе катализатора в данной реакции была верной; а во-вторых, мы получили исчерпывающее представление о том, какую структуру нам следует синтезировать. Ясно также, что получение искусственных алмазом методом детонационного синтеза не может служить промышленным источником углеродных катализаторов в количествах, измеряемых тоннами, – а потребность в этих компонентах именно такова. Тут нам нужно разработать какую-то иную технологию.
Какой метод окажется наиболее эффективным, пока сказать трудно. Однако уже сейчас очевидно: ни совсем плоские чешуйки, ни слишком сильно искривлённые не годятся на роль катализатора. Идеальной пространственной формой оказалась лёгкая вогнутость. Роберт Шлёгль говорит:
Именно эти участки нам и нужны. И мы увеличиваем их количество за счёт того, что стараемся создать в системе оптимальное внутренне напряжение. Если привнести слишком сильное напряжение, получится гомогенно замкнутое тело; такая форма не годится. Если не прикладывать никакого напряжения, то получатся плоские пластины, вообще не имеющие дефектных участков и, как следствие, активных центров, за исключением физической границы чешуйки. Если же выбрать правильное напряжение, в структуре образуется множество мелких дефектов, и это как раз то, что надо.
Луковичные чешуйки из углерода оказались весьма эффективным катализатором в производстве стирола. Они позволили почти две трети объёма исходного сырья превратить в конечный продукт, в то время как для катализатора на базе оксидов железа этот показатель не превышает 50 процентов. Но основное преимущество нового катализатора не в этом. Промышленность рассчитывает на значительную выгоду от внедрения новинки по другой причине. Роберт Шлёгль говорит:
Главный недостаток используемой сегодня стандартной промышленной технологии состоит в том, что катализатор на базе оксидов железа сам по себе не способен обеспечить протекание реакции, он требует десятикратного количества водяного пара. Значит, для производства 20 миллионов тонн стирола приходится производить 200 миллионов тонн водяного пара, совершенно нам не нужного. Достаточно подсчитать, во что обходится производство этого пара, и сразу же становится ясно, каких огромных потерь удалось бы избежать, если бы можно было отказаться от этих бессмысленных энергозатрат. Вот в этом и заключается самое главное достоинство нашей технологии: она вообще не требует водяного пара. То есть тут речь идёт не о том, чтобы несколько сократить энергоёмкость процесса, а о том, чтобы сэкономить всю энергию, которая сегодня расходуется на получение пара.
А кроме того, это означает, что стирол можно будет производить на небольших предприятиях и тем самым уменьшить объёмы транспортировки опасных грузов и связанный с этим риск – ведь стирол, напомню, ядовит.
Дальнейшая переработка стирола связана, как правило, с процессом так называемой полимеризации. Он является одним из основных процессов в производстве пластмасс и состоит в последовательном присоединении молекул мономера к активному центру на конце растущей цепи. Иногда в силу разных причин синтез таких длинных молекул нарушается, и цепи, вместо того, чтобы расти только в длину, начинают ветвиться. Вместо линейных полимеров образуются так называемые дендримеры. До сих пор технологи старались всячески подавить подобные нежелательные реакции. Однако теперь химики обнаружили, что и ветвистые молекулы могут найти широкое применение в промышленности. Группа учёных Боннского университета во главе с Фрицем Фёгтле (Fritz Vögtle) с недавних пор изучает свойства этих молекул, своей структурой напоминающих трёхмерную снежинку или развесистую древесную крону. Получение молекул-дендримеров не представляет особых трудностей, – говорит Фриц Фёгтле:
Преимущество состоит в том, что достаточно синтезировать лишь один фрагмент такого пирога – ядро макромолекулы, – а дальше она растёт сама собой. То есть весь дальнейший синтез уже не требует ни усилий, ни расходов.
Многие полезные свойства дендримеров напрямую вытекают из их структуры. Так, наличие пустот внутри молекул позволяет использовать их в качестве фильтров, пропускающих лишь те частицы, линейные размеры которых не превышают определённой предельной величины. Те же самые пустоты делают возможной и совсем иную сферу применения дендримеров: в них можно как бы «спрятать» те или иные субстанции – например, лекарственные препараты, – и таким образом «протащить» их через такие трудно преодолимые барьеры, как, скажем, оболочка клетки. Дендримеры, способные транспортировать внутрь клетки наследственный материал, уже имеются на рынке. А поскольку на такие молекулы можно навесить и частицы флуоресцентных красителей, они идеально подходят на роль биомаркеров и экосенсоров. Ведь использование именно таких красителей лежит в основе многих методов медицинской диагностики, равно как и технологий природоохранного мониторинга. Фриц Фёгтле говорит:
Внутри дендримеров можно разместить множество флуоресцентных частиц, и это обеспечивает более высокую точность измерений. Кроме того, значительно повышается чувствительность метода. Ведь чем больше частиц красителя вы можете внедрить в маркер, тем в более широких пределах он способен производить измерения.
С недавних пор особый интерес учёных вызывают молекулы не сферической, а цилиндрической формы. При диаметре всего в несколько нанометров такие макромолекулы могут достигать в длину сотен нанометров и относятся, таким образом, к самым крупным молекулам из всех, когда-либо созданных химиками.
По мнению Дитера Шлютера (Dieter Schlüter), профессора химии в Свободном университете Берлина, это открывает перед исследователями новые перспективы:
Работая с такими большими, действительно очень большими молекулами, можно попытаться перекинуть мост между биологией и материаловедением, поскольку мы как бы находимся в той области величин, к которой относятся и биологически активные молекулы или, скажем, вирусы. А это позволяет обратиться к очень интересным вопросам. Так, материаловеды могут попытаться придать какому-то веществу определённые физические свойства, выстраивая их снизу, с молекулярного уровня. Но для этого нужны молекулы такой величины, чтобы можно было использовать вполне определённые технологии и методы исследования – например, атомносиловую туннельную микроскопию.
Эта техника уже сегодня позволяет с помощью очень тонкой иглы изымать из образца отдельные молекулы и переносить их на другое место. Дитер Шлютер тоже говорит о разных сферах практического применения своих цилиндрических молекул – например, в качестве миниатюрных токопроводящих кабелей. Правда, это потребует ещё нескольких лет напряжённого труда.
Владимир Фрадкин, НЕМЕЦКАЯ ВОЛНА
зачем нужен и почему ценится?
Катализатор, он же каталитический нейтрализатор — это специализированная запчасть, предназначенная для очистки выхлопных газов. Катализатор содержит драгметаллы, поэтому ценен даже после окончания срока эксплуатации.
Представляет собой носитель, изготовленный из керамики или металлической фольги с мелкоячеистой структурой. На внутренней поверхности ячеек напылен тонкий каталитический слой, содержащий драгоценные металлы. Мельчайшие частицы платины, палладия, родия взаимодействуют с раскаленными газами, поступающими из двигателя. В этот момент происходит окисление ядовитых веществ до безопасных для окружающей среды показателей.
Несгоревшие остатки окиси углерода (СО), углеводорода (СН) задерживаются на поверхности каталитического слоя и остокисляются кислородом. Итогом реакции является выделение углекислого газа (CO2).
Управляет работой выпускной системы кислородный датчик, который определяет соотношение воздуха и бензина в горючей смеси.
В автомобиле может быть как один катализатор, так и несколько. Находятся они в выпускной системе, между двигателем и глушителем, и обычно защищены дополнительным теплоотражающим экраном.
Катализаторами оснащаются все современные автомобили, как отечественного, так и зарубежного производства. Это «расходник», который со временем выходит из строя и нуждается в замене.
Что делать с использованным катализатором?
Сдать его в переработку. ООО «Скупка Катализаторов» принимает отработавшие свой срок детали у физических и юридических лиц. Компания предлагает оптимальные условия для долгосрочного взаимовыгодного сотрудничества.
Катализаторы могут быть в любом состоянии: целыми, колотыми, а также молотыми. При приеме производится предварительная оценка стоимости. Финальная стоимость зависит от результата спектрального анализа (РФА), который проводится при помощи портативного спектрального анализатора, и текущих котировок LME.
Сдать катализатор вы можете лично (тогда деньги за него вы получите сразу после проведения анализа) или отправить почтой/транспортной компанией (в этом случае оплата осуществляется после получения посылки в день проведения анализа переводом: банковским или на электронный кошелек).
Связаться с менеджерами для сдачи катализаторов можно по тел. +7(495) 266-67-37, +7(925) 468-22-21 или заказать обратный звонок, заполнив форму на сайте.
ИССЛЕДОВАНИЕ ПРОЦЕССА АРОМАТИЗАЦИИ СЫРЬЯ РИФОРМИНГА НА ЦЕОЛИТСОДЕРЖАЩЕМ КАТАЛИЗАТОРЕ | Муниров
Технический регламент «О требованиях к автомобильному и авиационному бензину, дизельному и судовому топливу, топливу для реактивных двигателей и топочному мазуту». Постановление Правительства Российской Федерации от 27 февраля 2008 г. № 18.
Кондрашев Д.О. Повышение выхода и качества риформата за счет совместного применения ступенчатого риформинга и процесса гидроизомеризации // Катализ в промышленности. 2017. № 1. С. 31-36.
Ахметов Т.В., Терегулова Э.И., Абдульминев К.Г. Варианты комбинированных технологий каталитического риформинга и изомеризации // Нефтепереработка и нефтехимия. 2012. № 12. С. 27-29.
Ясакова Е.А., Ситдикова А.В., Морозов А.Н., Ахметов А.Ф. Разработка вариантов производства высокооктановых бензинов в ОАО «Салаватнефеоргсинтез» // Технологии нефти и газа. 2010. № 2. С. 3-10.
Кирьянов Д.И., Смоликов М.Д., Пашков В.В., Проскура А.Г., Затолокина Е.В., Удрас И.Е., Белый А.С. Современное состояние процесса каталитического риформинга бензиновых фракций. Опыт производства и промышленной эксплуатации катализаторов риформинга серии ПР // Российский химический журнал. 2007. № 4. С. 60-69.
Плешакова Н.А., Рохманько Е.Н., Салмина И.В., Черепкова Н.Д., Бубнова О.В., Тыщенко В.А., Рудяк К.Б. Опыт эксплуатации отечественных и зарубежных катализаторов риформинга на различных типах сырья // Нефтепереработка и нефтехимия. 2013. № 6. С. 21-25.
Крылов В.А., Ходяшев Н.Б., Подвинцев И.Б., Болотова Е.С., Чиркова Н.А. Влияние характера коксовых отложений на показатели работы платино-рениевого катализатора риформинга // Нефтепереработка и нефтехимия. 2013. № 5. С. 14-18.
Гынгазова М.С., Чеканцев Н.В., Короленко М.В., Иванчина Э.Д., Кравцов А.В. Оптимизация кратности циркуляции катализатора в реакторе риформинга с движущимся зернистым слоем сочетанием натурного и вычислительного эксперимента // Катализ в промышленности. 2012. № 2. С. 35-41.
Кравцов А.В., Иванчина Э.Д., Костенко А.В., Шарова Е.С., Фалеев С.А. Анализ эффективности эксплуатации платиносодержащих катализаторов процесса риформинга бензинов с использованием компьютерной моделирующей системы // Нефтепереработка и нефтехимия. 2008. № 11. С. 18-23.
Маслянский Г.Н., Шапиро Р.Н. Каталитический риформинг бензинов: Химия и химическая технология. Л.: Химия, 1985. 224 с.
Костенко А.В., Молотов К.В., Иванчина Э.Д., Кравцов А.В., Фалеев С.А., Абрамин А.Л. Разработка и применение технологических критериев оценки активности и стабильности Pt-катализаторов риформинга бензинов методом математического моделирования // Нефтепереработка и нефтехимия. 2007. № 6. С. 18-22.
Костенко А.В., Молотов К.В., Кравцов А.В., Иванчина Э.Д., Ясюкевич О.М. Мониторинг установки ЛЧ-35-11/1000 с использованием компьютерной системы контроля работы катализаторов риформинга // Нефтепереработка и нефтехимия. 2007. № 4. С. 13-16.
Короленко М.В., Гынгазова М.С., Чеканцев Н.В., Иванчина Э.Д., Кравцов А.В. Оптимизация работы блока платформинга установки Л-35/11-1000 ОАО «Газмпромнефть-ОНПЗ» с применением расчетов на математической модели процесса // Нефтепереработка и нефтехимия. 2013. № 2. С. 10-15.
Иванчина Э.Д., Ивашкина Е.Н., Чеканцев Н.В., Францина Е.В., Шарова Е.С. Создание и применение моделирующих систем каталитических нефтехимических процессов в промышленных реакторах // Нефтепереработка и нефтехимия. 2013. № 5. С. 20-26.
Костенко А.В., Кравцов А.В., Иванчина Э.Д., Ивашкина Е.Н. Оптимизация внутренних устройств реакторов риформинга с использованием нестационарной кинетической модели // Нефтепереработка и нефтехимия. 2007. № 1. С. 18-22.
Крылов В.А. Совершенствование процессов гидроочистки дизельных топлив и каталитического риформинга бензиновых фракций для переработки вторичных дистиллятов: дисс. … канд. техн. наук. Пермь, 2007. 160 с.
Колесников С.И., Кильянов М.Ю., Икорников Д.М., Гущин П.А., Иванов Е.В. Модифицирование катализаторов для процесса каталитического риформинга низкого давления // Нефть, газ и бизнес. 2013. № 1. С. 66-67.
Колесников И.М., Винокуров В.А., Кильянов М.Ю., Колесников С.И., Чеховская О.М. Особенности риформинга бензинов на смешанных цеолит Al-Co-Mo-O катализаторах // Нефть, газ и бизнес. 2010. № 5. С. 79-84.
Кузьмина Р.И., Фролов М.П., Ливенцев В.Т., Ветрова Т.К., Ковнев А.В. Разработка цеолитсодержащего катализатора риформинга // Катализ в промышленности. 2010. № 6. С. 29-34.
Новых Уменьшенной Платиновый катализатор для каталитических нейтрализаторов
Выберите страну / регион *Выберите страну / regionUnited StatesCanadaAfghanistanAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntarcticaAntigua и BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBoliviaBosnia и HerzegovinaBotswanaBouvet IslandBrazilBritish Индийского океана TerritoryBrunei DarussalamBulgariaBurkina FasoBurundiCambodiaCameroonCape VerdeCayman IslandsCentral африканского RepublicChadChileChinaChristmas IslandCocos (Килинг) IslandsColombiaComorosCongoCongo, Демократической Республика ofCook IslandsCosta RicaCote D ‘ИвуарХорватияКубаКипрЧешская РеспубликаДанияДжибутиДоминикаДоминиканская РеспубликаВосточный ТиморЭквадорЭгипетЭль-СальвадорЭкваториальная ГвинеяЭритреяЭстонияЭфиопияФолклендские острова (Мальвина) Фарерские островаФиджиФинляндияФинляндияФермания Югославия Франция Франция Франция МакедонияГермания anaGibraltarGreeceGreenlandGrenadaGuadeloupeGuamGuatemalaGuineaGuinea-BissauGuyanaHaitiHeard и McDonald IslandsHoly Престол (Ватикан) HondurasHong KongHungaryIcelandIndiaIndonesiaIran (Исламская Республика) IraqIrelandIsraelItalyJamaicaJapanJordanKazakstanKenyaKiribatiKorea, Корейские Народно-Демократической RepKorea, Республика ofKuwaitKyrgyzstanLao Народный Демократической RepLatviaLebanonLesothoLiberiaLibyan Arab JamahiriyaLiechtensteinLithuaniaLuxembourgMacauMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMayotteMexicoMicronesia, Федеративные StatesMoldova, Республика ofMonacoMongoliaMontserratMoroccoMozambiqueMyanmarNamibiaNauruNepalNetherlandsNetherlands AntillesNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorthern Mariana IslandsNorwayOmanPakistanPalauPanamaPapua Нового GuineaParaguayPeruPhilippinesPitcairnPolandPortugalPuerto RicoQatarReunionRomaniaRussian FederationRwandaSaint HelenaSaint Китс и Невис Сент-Люсия Сен-Пьер и Микелон Самоа Сан — MarinoSao Томе и PrincipeSaudi ArabiaSenegalSeychellesSierra LeoneSingaporeSlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSpainSri LankaSth Georgia & Sth Sandwich Институт социальных Винсент и GrenadinesSudanSurinameSvalbard и Ян MayenSwazilandSwedenSwitzerlandSyrian Arab RepublicTaiwan, провинция ChinaTajikistanTanzania, Объединенная Республика ofThailandTogoTokelauTongaTrinidad и TobagoTunisiaTurkeyTurkmenistanTurks и Кайкос IslandsTuvaluUgandaUkraineUnited Арабские EmiratesUnited KingdomUruguayUS Малые отдаленные IslandsUzbekistanVanuatuVenezuelaVietnamVirgin острова (Британские) Виргинские острова ( U.S.) Острова Уоллис и Футуна Западная Сахара ЙеменЮгославия Замбия Зимбабве
Платиновый катализатор — обзор
1 ВВЕДЕНИЕ
Комбинированные рутениево-платиновые катализаторы получают с целью использования соответствующих каталитических свойств обоих металлов. Рутений, способный диссоциировать молекулы водорода, усиливает активность катализатора, а платина предотвращает чрезмерную дезактивацию катализатора. Комбинация рутения и платины особенно выгодна из-за некоторых специфических особенностей: (i) кристаллические частицы Ru-Pt образуются во всем диапазоне составов металлов, (ii) биметаллические кластеры Ru-Pt достаточно стабильны как в окислительной, так и в восстановительной атмосфере, (iii) оба металла являются эффективными катализаторами во многих интересных реакциях, (iv) Ru и Pt являются легко восстанавливаемыми металлами, и (v) оба металла демонстрируют четко определенную стехиометрию в хемосорбции водорода [1].
Диоксид циркония считается нейтральным носителем из-за его двойных поверхностных характеристик: окислительных или восстановительных и основных или кислотных. Более того, диоксид циркония является более реакционноспособным носителем, чем диоксид кремния и оксид алюминия, и, следовательно, с более сильным взаимодействием металла с носителем.
В этой конкретной работе Ru (NO) (NO 3 ) 3 и H 2 PtCl 6 ⋅ 2H 2 O были выбраны в качестве металлических прекурсоров для их включения на носитель из диоксида циркония. В растворе присутствуют различные виды рутения в зависимости от pH: нейтральные, анионные или катионные комплексы общей формулы [Ru (NO) (H 2 O) x (NO 3 ) 5 -x ] x- 2 [2, 3].В водном растворе платинохлористоводородная кислота подвергается гидратации и гидролизу и ведет себя как слабая кислота с pK a = 3,8 [2, 4].
Анализ TPR позволяет изучить восстанавливаемость, природу и количество или распределение различных восстанавливаемых частиц, присутствующих в образце каталитического предшественника [5–7]. Таким образом, можно изучить взаимодействие металл-носитель, состояние, в котором нанесенные металлы могут находиться в катализаторе, и взаимное влияние на их восстанавливаемость [8, 9].
Гидрогенолиз метилциклопентана (MCP) был использован для изучения каталитической поверхности из-за его чувствительности к дисперсии металлов и электронной структуре [10–14].В зависимости от условий работы и типа катализатора возможно получение продуктов реакций раскрытия цикла, крекинга, расширения кольца и ароматизации в случае кислотных центров в катализаторе [11, 12, 15].
Рутений и платина ведут себя в этой реакции по-разному. Рутений активен при 413 К и показывает высокую гидрогенолитическую способность. Однако платина не может активировать молекулу водорода так же, как рутений, и активна при 493 К. При легировании рутения платиной можно ожидать снижения активности и глубокого гидрогенолиза в пользу селективности по отношению к C 6 [11, 12, 16 ].
Целью данной работы является определение стабилизирующего действия платины на металлическую фазу рутения при нанесении на диоксид циркония вместо более традиционных носителей, таких как SiO 2 , Al 2 O 3 или TiO 2 . Также изучается влияние предварительной обработки как для монометаллических рутениевых, так и для биметаллических рутений-платиновых катализаторов.
Катализатор и катализ | Encyclopedia.com
Катализатор — это вещество, которое инициирует или ускоряет скорость определенной химической реакции, не подвергаясь химическому воздействию.Катализатор может быть добавлен в реакцию, а затем восстановлен и повторно использован после того, как реакция протекает. Процесс или действие, посредством которого катализатор увеличивает скорость реакции, называется катализом. Кинетика — это изучение скорости реакции и ее изменения при экспериментальном воздействии.
Люди использовали процесс, известный как катализ, задолго до того, как они поняли, что происходит в этом процессе. Например, мыловарение, ферментация вина до уксуса и закваска хлеба — все это процессы, которые включают катализ.Обычные люди использовали эти процедуры в своей повседневной жизни, даже не подозревая, что это был катализ.
Термин «катализ» был предложен в 1835 году шведским химиком Йенсом Берцелиусом (1779–1848). Этот термин происходит от греческих слов «вниз», ката, и «ослабить», льеин. Берцелиус объяснил, что под термином «катализ» он понимал свойство оказывать на другие тела действие, которое сильно отличается от химического сродства. Посредством этого действия они производят разложение в телах и образуют новые соединения, в состав которых не входят.
Одним из примеров катализа, знакомых Берцелиусу, было превращение крахмала в сахар в присутствии сильных кислот. В 1812 году русский химик Готлиб Сигизмунд Константин Кирхгоф (1764–1833) изучил эту реакцию. Он обнаружил, что при кипячении водной суспензии крахмала в крахмале не происходит никаких изменений.
Однако, когда несколько капель концентрированной серной кислоты добавляются к той же суспензии перед кипячением, крахмал распадается на простой сахар, называемый глюкозой.Кислота может быть извлечена из реакции в неизменном виде. Кирххоф пришел к выводу, что он сыграл вспомогательную роль в расщеплении крахмала, но сам по себе не претерпел никаких изменений.
Берцелиус смог использовать многие другие примеры катализа. Например, английский химик сэр Хамфри Дэви (1778–1829) и немецкий химик Иоганн Вольфганг Доберейнер (1780–1849) изучали влияние металлической платины на определенные органические реакции. Они пришли к выводу, что металл увеличивает скорость, с которой происходят эти реакции, без каких-либо изменений.Самый известный протеже Дэви, английский физик и химик Майкл Фарадей (1791–1867), также продемонстрировал способность платины вызывать рекомбинацию водорода и кислорода, которая была получена при электролизе воды.
Когда Берцелиус впервые дал определение катализу, он имел в виду некую силу или силу, с помощью которой агент (катализатор) воздействует на реакцию. Он предположил, например, что платина может оказывать электрическую силу на газы, с которыми она вступает в контакт, чтобы вызвать изменение скорости реакции.
Такое объяснение хорошо работает для гетерогенного катализа, в котором катализатор и реакция находятся в разных фазах. Например, в реакции, катализируемой платиной, платина находится в твердом состоянии, а реакция — в газообразном или жидком состоянии.
Гомогенный катализ, в котором катализатор и реакция находятся в одном и том же состоянии, требует другого объяснения. Как, например, серная кислота в жидком состоянии вызывает преобразование суспензии крахмала, с которой она смешана?
Решение этой проблемы пришло в начале 1850-х годов.Британский химик-органик Александр Уильям Уильямсон (1824–1904) проводил исследования по получению эфиров из спирта. Химики знали, что концентрированная серная кислота является эффективным катализатором этой реакции, но не знали почему. Уильямсон смог продемонстрировать, что катализатор действительно разрушается на первой стадии этой реакции, но регенерируется в своей исходной форме по завершении реакции.
Роль катализаторов в живых системах была впервые признана в 1833 году.Французские химики Ансельм Пайен (1795–1871) и Жан Франсуа Персо (1805–1869) выделили из солода материал, который ускорял превращение крахмала в сахар. Пайен назвал это вещество диастазой. Полвека спустя немецкий физиолог Вилли Кюне (1837–1900) предложил название «фермент» для катализаторов, встречающихся в живых системах.
К концу девятнадцатого века катализаторы быстро стали играть важную роль в различных промышленных применениях. Синтез индиго стал коммерческой возможностью в 1897 году, когда было случайно обнаружено, что ртуть катализирует реакцию, в результате которой образуется индиго.Катализ также сделал возможным промышленное производство аммиака из его элементов (процесс Габера-Боша), азотной кислоты из аммиака (процесс Оствальда) и серной кислоты из оксидов серы (контактный процесс).
Большинство химических реакций происходит в несколько этапов. Эта последовательность шагов называется путем или механизмом. Каждый отдельный шаг называется элементарным шагом, причем самый медленный элементарный шаг в пути определяет скорость реакции. Скорость реакции — это скорость, с которой реагенты (вещества, которые подвергаются химической реакции) исчезают, а продукты появляются как конечный результат химической реакции; или, более конкретно, изменение концентрации реагентов и продуктов за определенный промежуток времени.
Проходя путь реакции, реагенты входят в переходное состояние, когда они больше не являются реагентами, но еще не являются продуктами. Во время этого переходного состояния они образуют так называемый активированный комплекс. Активированный комплекс недолговечен и имеет частичные характеристики связывания как реагентов, так и продуктов. Энергия, необходимая для достижения этого переходного состояния и образования активированного комплекса в реакции, называется энергией активации. Чтобы реакция произошла, должна быть достигнута энергия активации.
Катализатор увеличивает скорость реакции за счет снижения энергии активации, необходимой для протекания реакции. Катализатор образует активированный комплекс с меньшей энергией, чем комплекс, образованный без катализа. Это дает реагентам новый путь, требующий меньше энергии. Хотя катализатор снижает требуемую энергию активации, он не влияет на реакционное равновесие или термодинамику. Катализатор не фигурирует в общем химическом уравнении пути, потому что механизм включает элементарную стадию, на которой катализатор расходуется, и другую, на которой он регенерируется.
Металлы часто используются в качестве гетерогенных катализаторов, потому что многие реагенты адсорбируются на поверхности металла, увеличивая концентрацию реагентов и, следовательно, скорость реакции. Ионные взаимодействия между металлами и другими молекулами могут использоваться для ориентации задействованных реагентов так, чтобы они лучше реагировали друг с другом, или для стабилизации заряженных переходных состояний реакции. Металлы также могут увеличивать скорость окислительно-восстановительных реакций за счет изменения степени окисления иона металла.
Другая группа катализаторов называется ферментами. Они являются сильными катализаторами, присутствующими в биологических системах. Ферменты — это белки; следовательно, иметь сильно сложенную трехмерную конфигурацию. Эта конфигурация делает фермент особенно специфичным для определенной реакции или типа реакции. С другой стороны, синтетические катализаторы далеко не так специфичны. Они будут катализировать аналогичные реакции, в которых участвуют самые разные реагенты. Ферменты, как правило, теряют активность легче, чем синтетические катализаторы.Очень незначительные нарушения белковой структуры ферментов изменят трехмерную конфигурацию молекулы и, как следствие, ее реактивность. Ферменты, как правило, более активны; т.е. они катализируют реакции быстрее, чем синтетические катализаторы при температуре окружающей среды. Каталитическая активность реакции выражается числом оборотов. Это просто количество молекул реагента, превращенных в продукт на один участок катализатора за заданную единицу времени. При повышении температуры синтетические катализаторы становятся такими же активными, как и ферменты.При повышении температуры многие ферменты становятся неактивными из-за изменения структуры белка.
Есть бесконечное количество реакций, которые могут подвергаться катализу. Одним из примеров является разложение перекиси водорода (H 2 O 2 ). Без катализа перекись водорода со временем медленно разлагается с образованием воды и газообразного кислорода. 30% раствор перекиси водорода при комнатной температуре разлагается со скоростью 0,5% в год. Энергия активации этой реакции составляет 75 килоджоулей на моль (кДж / моль).Эту энергию активации можно снизить до 58 кДж / моль за счет добавления иодид-ионов (I — ). Эти ионы образуют промежуточный продукт, HIO —, который реагирует с перекисью водорода для регенерации иодид-ионов. Когда фермент каталаза (фермент, обнаруженный в большинстве клеток растений и животных, который действует как окислительный катализатор) добавляется к раствору перекиси водорода, энергия активации снижается еще больше до 4 кДж / моль. Каталаза также регенерируется в реакции и может быть выделена из раствора для повторного использования.Этот пример показывает, как катализатор может снизить энергию активации реакции, не используя себя в ходе реакции.
Другой пример катализа — автомобильный каталитический нейтрализатор. Выхлопные газы автомобиля могут содержать угарный газ и оксиды азота, которые являются ядовитыми газами. Прежде чем выхлопные газы смогут покинуть выхлопную систему, эти токсины должны быть удалены. Каталитический нейтрализатор смешивает эти газы с воздухом, а затем пропускает их через катализатор из родия и платиновых металлов.Этот катализатор ускоряет реакцию оксида углерода с кислородом и превращает его в диоксид углерода, который не токсичен. Катализатор также увеличивает скорость реакций, в которых оксиды азота распадаются на их элементы.
Хорошо известный пример катализа — естественное разрушение озонового слоя. Озон (O 3 ) в верхних слоях атмосферы служит защитой от вредных ультрафиолетовых лучей Солнца. Озон образуется при расщеплении молекулы кислорода (O 2 ) на два атома кислорода (O) излучением Солнца.Затем свободные атомы кислорода присоединяются к молекулам кислорода с образованием озона. Когда другой свободный атом кислорода реагирует с молекулой озона, образуются две молекулы кислорода. Это естественное разрушение озона. В нормальных условиях скорость разрушения озона такая же, как и скорость образования озона, поэтому чистого разрушения озона не происходит.
Однако, когда атомы хлора (Cl) присутствуют в атмосфере, они действуют как катализаторы разрушения озона. Атомы хлора в атмосфере происходят из соединений, содержащих хлорфторуглероды или CFC.ХФУ — это соединения, содержащие хлор, фтор и углерод. Они очень стабильны и могут дрейфовать в верхние слои атмосферы без предварительного разрушения. Попадая в верхние слои атмосферы, энергия Солнца вызывает выделение хлора. Атом хлора реагирует с озоном с образованием монооксида хлора (ClO) и молекулы кислорода. Затем монооксид хлора реагирует с другим атомом кислорода с образованием молекулы кислорода и регенерированного атома хлора. С помощью хлорного катализатора разложение озона происходит быстрее, чем его образование, что привело к чистому истощению озона в атмосфере.
Предыдущие примеры иллюстрируют некоторые из многих практических приложений катализа. Почти все химические вещества, производимые химической промышленностью, производятся с использованием катализа. Каталитические процессы, используемые в химической промышленности, снижают производственные затраты, а также создают продукты с более высокой чистотой и меньшим риском для окружающей среды. Благодаря каталитическим процессам производится широкий ассортимент продукции. Катализ используется в промышленной химии, фармацевтической химии и агрохимии, а также в специальной химической промышленности.Полезные химические вещества, такие как серная кислота, пенициллин и фруктоза, производятся более эффективно с помощью каталитических процессов. Научно-исследовательские и опытно-конструкторские работы в химической промышленности значительно более продуктивны с использованием катализа в таких областях, как очистка топлива, нефтехимическое производство и управление окружающей средой.
В большинстве производственных процессов, используемых сегодня в химической промышленности, используются каталитические реакции. Эти реакции очень эффективны, но исследования продолжают повышать эффективность еще больше.Основное внимание в этом исследовании уделяется разделению и регенерации катализаторов с целью снижения производственных затрат при одновременном повышении чистоты продукта. Область исследований катализа быстро растет и будет продолжать расти по мере открытия новых катализаторов и каталитических процессов.
Центр производства катализаторов | Университет Рутгерса, химическая и биохимическая инженерия
Катализаторы — важные компоненты многих промышленных процессов, от каталитических нейтрализаторов и топливных элементов до производства новейших лекарств.Мировые продажи гетерогенных и гомогенных катализаторов составляют десятки миллиардов долларов в год, при этом темпы роста составляют около 5% в год. Помимо их промышленного значения, катализаторы оказывают значительное воздействие на окружающую среду. Количество энергии и сырья, необходимых для производства химикатов, значительно сокращается за счет использования катализаторов. Каталитические нейтрализаторы в значительной степени снижают загрязнение воздуха от автомобилей и, таким образом, являются важным приложением в области экологической инженерии. Дизельное топливо с низким содержанием серы и бензин невозможно рентабельно производить без катализаторов гидрообессеривания, что приводит к снижению выбросов диоксида серы (SO2) в результате использования этих видов топлива в автомобилях, грузовиках, самолетах и кораблях.
Катализаторы на носителе включают распределение активного каталитического материала (который обычно представляет собой металл) через пористый твердый носитель. Современные катализаторы на носителе имеют много преимуществ, таких как большая площадь поверхности, небольшое количество часто дорогостоящего активного металлического компонента и высокая механическая и термическая стабильность. Конструкция типичного катализатора на носителе включает в себя большое количество качественных характеристик. Для гранул катализатора это может включать определенные количества активного металла (ов) в носителе, определенное распределение активного металла (ов) от центра к поверхности и заданную дисперсию.Оптимальное качество катализатора позволяет проводить химические реакции наиболее эффективным, экономичным и экологически безопасным способом и, таким образом, сокращать потребление сырья, потребность в энергии и выбросы парниковых газов. Оптимизация производственных этапов может снизить вариабельность от партии к партии и потенциально может снизить содержание металлов в катализаторах, что снижает производственные затраты. На химических и нефтехимических предприятиях высококачественные катализаторы могут снизить потребность в сырье и потребление энергии за счет повышения выхода реакции и селективности.Повышенный выход реакции позволяет использовать реакторные сосуды меньшего размера, более низкие рабочие температуры и более эффективное использование реагентов. Более высокая селективность снижает потребность в дорогостоящих и энергоемких этапах разделения. Хотя разработка и приготовление катализаторов изучались в течение многих лет, многочисленные аспекты различных стадий производства катализаторов до сих пор полностью не изучены, и в промышленности разработка и масштабирование стадий производства катализаторов часто выполняются методом проб и ошибок.
Производство промышленных катализаторов включает в себя несколько технологических этапов, таких как приготовление и смешивание растворов или суспензий, кристаллизация, фильтрация, промывка, смешивание и замешивание порошков, формовочная сушка, пропитка и прокаливание.
Перед началом любого процесса подготовки необходимо тщательно выбрать активную металлическую фазу и основу. Активный металлический компонент должен быть хорошо диспергированным, чтобы иметь большую площадь поверхности при контакте с подложкой.С другой стороны, опора должна быть из пористого и жаропрочного материала. Некоторые общие технологические этапы производства катализатора обсуждаются ниже.
Пропитка: Во время этого процесса раствор, содержащий активные металлические компоненты (т.е. прекурсоры), добавляется к пористым носителям катализатора. Капиллярное действие втягивает раствор в поры, а прекурсоры металлов адсорбируются на носителе с большой площадью поверхности. Это первый случай, когда предшественник металла контактирует с твердой подложкой.Если объем раствора меньше объема пор носителя, процесс также известен как пропитка по начальной влажности или сухая пропитка. Сухая пропитка обычно проводится во вращающемся сосуде, в то время как раствор металла распыляется на частицу носителя. Этот метод широко используется и до сих пор считается фаворитом в отрасли из-за своей простоты с практической точки зрения. В процессе сухой пропитки потенциально могут использоваться многие типы смесителей для гранулирования, включая двухконусные смесители, v-образные смесители и смесители с вращающимся барабаном.Скорость распыления, скорость вращения и положение форсунки существенно влияют на распределение раствора. Другие параметры, которые необходимо учитывать, — это концентрация раствора, объем пор носителя, а также тип и концентрация участков поглощения на поверхности. Однородность продуктов катализатора является одной из основных проблем в этом процессе. После стадии пропитки необходимо, чтобы в каждой частице / таблетке катализатора была получена аналогичная загрузка металла.
Сушка: Материалы проходят процесс сушки после пропитки для удаления растворителей с основы.Если скорость сушки низкая, соли металлов будут глубоко диффундировать в порах носителя, а если скорость сушки высокая, на внешней поверхности носителя будет происходить осаждение. Что касается распределения активного компонента в носителе, можно выделить четыре основных категории металлических профилей: однородные, яичный желток, яичная скорлупа и яичный белок. Выбор желаемого профиля металла определяется требуемой активностью и селективностью и может быть адаптирован для конкретных реакций и / или процессов.Экспериментальные работы показали, что распределение металла в носителе в основном определяется стадиями пропитки и сушки. Некоторые факторы, влияющие на процесс сушки: скорость нагрева, степень насыщения жидкостью, вязкость жидкости, объем пор и распределение пор по размерам.
Прокаливание: Прокаливание — это дополнительная термообработка после сушки. На стадии прокаливания происходят поверхностные реакции газ-твердое тело и твердое тело-твердое тело. Прокаливание приведет к разложению предшественника металла с образованием оксида и удалению газообразных продуктов и ранее введенных катионов или анионов.Во время прокаливания может происходить спекание предшественника или образовавшегося оксида и реакция оксида металла с носителем. В случае оксида алюминия в качестве носителя, если прокаливание выполняется при температурах около 500-600 ° C, оксиды двухвалентных металлов могут реагировать с оксидом алюминия на поверхности носителя, образуя алюминаты металлов, которые более стабильны, чем оксиды. Окисление уменьшает размер металлических частиц, что сильно влияет на дисперсию металла (размер и форму металлических частиц на поверхности носителя) на наномасштабе.При прокаливании катализаторов требуется тщательный контроль температуры.
Фильтрация: Фильтрация — это один из процессов разделения твердой и жидкой фаз, которые широко используются при производстве катализаторов для осажденных или кристаллизованных частиц катализатора. При фильтрации кека поток суспензии твердых частиц, управляемый давлением или вакуумом, через мембрану фильтра или фильтровальную ткань вызывает разделение, и осадок, образованный из твердых частиц, со временем накапливается на мембране фильтра или фильтровальной ткани.Как правило, фильтрующая среда (мембрана или ткань) имеет довольно большие отверстия, и более строгая фильтрация осуществляется за счет самой корки, которая представляет собой пористую среду, в которой поры представляют собой промежутки между частицами. Обычно проводится последующая промывка фильтрационной корки с целью удаления остаточных электролитов.
Центр производства катализаторов работает уже более 15 лет. Наша миссия — продвигать инновационные исследования в области производства катализаторов и обучать новое поколение исследователей теоретическим инструментам и инженерным приложениям.Конкретные цели центра:
- Создание и поддержание Центра передового опыта в области исследований в области производства катализаторов
- Для углубления фундаментального понимания операций по производству катализаторов
- Разработать новую технологию для эффективного производства катализаторов
- Предоставление ресурсов по исследованиям, разработкам и образованию для промышленности
Объединив значительный уровень знаний в области технологии частиц, оптимизации, многомасштабного моделирования, катализа и молекулярного моделирования, доступных в Rutgers, мы разрабатываем и продвигаем научно обоснованные методы для проектирования и оптимизации методов и процессов производства катализаторов, таких как пропитка, сушка, прокаливание, фильтрация и др.Это интегрировано с рядом образовательных мероприятий, включая исследовательскую подготовку студентов, аспирантов и докторантов в области производства катализаторов. Комбинация экспериментов и компьютерных моделей использовалась для улучшения понимания и эффективности операций, используемых для изготовления катализаторов. Эти знания и полученные в результате методы и практики были переданы промышленным партнерам, чтобы помочь преобразовать этот важный сегмент мировой экономики в наукоемкое предприятие.
Для получения дополнительной информации щелкните здесь, чтобы просмотреть брошюру
В настоящее время в состав входят 8 компаний, занимающихся разработкой и производством катализаторов. Размеры компаний варьируются от малых до крупных.
Бен Глассер (директор)
Билл Боргард
Фернандо Муццио
Сильвина Томассоне
Альберто Куитино
Центр производства катализаторов благодарит доктора Арта Честера за поддержку и вклад. Арт помог создать Центр производства катализаторов и много лет был приглашенным профессором в Rutgers.Арт скончался в 2015 году после продолжительной болезни. Арт был прекрасным наставником для многих преподавателей, аспирантов и студентов Рутгерса, и мы получили огромную пользу от его мудрости.
За дополнительной информацией обращайтесь:
Проф. Бен Глассер
Директор Консорциума по производству катализаторов
Химическая и биохимическая инженерия
Университет Рутгерса
98 Бретт-Роуд
Пискатауэй, штат Нью-Джерси, 08854, США
Что такое катализатор окисления дизельного топлива?
Катализаторы окисления дизельного топлива (DOC) — это каталитические нейтрализаторы, разработанные специально для дизельных двигателей и оборудования для снижения выбросов окиси углерода (CO), углеводородов (HC) и твердых частиц (PM).DOC просты, недороги, не требуют обслуживания и подходят для всех типов и применений дизельных двигателей.
Рис. 1. Как работает дизельный окислительный катализатор (DOC)
Современные каталитические нейтрализаторы состоят из монолитной сотовой подложки, покрытой катализатором из металла платиновой группы, упакованной в контейнер из нержавеющей стали. Ячеистая структура с множеством небольших параллельных каналов обеспечивает большую площадь контакта каталитического нейтрализатора с выхлопными газами. Когда горячие газы контактируют с катализатором, некоторые загрязнители выхлопных газов превращаются в безвредные вещества: углекислый газ и воду.
Катализатор окисления дизельного топлива предназначен для окисления монооксида углерода, углеводородов в газовой фазе и фракции твердых частиц дизельного топлива в SOF до CO 2 и H 2 O:
Выхлоп дизеля содержит достаточное количество кислорода, необходимого для вышеуказанных реакций. Концентрация O 2 в выхлопных газах дизельного двигателя колеблется от 3 до 17% в зависимости от нагрузки двигателя.Типичные значения эффективности преобразования CO и HC в дизельном катализаторе окисления Nett ® приведены на рисунке 2. Активность катализатора увеличивается с температурой. Для «выключения» катализатора необходима минимальная температура выхлопных газов около 200 ° C. При повышенных температурах конверсия зависит от размера и конструкции катализатора и может превышать 90%.
Рис. 2. Каталитическая конверсия окиси углерода и углеводородовПреобразование твердых частиц дизельного топлива является важной функцией современного катализатора окисления дизельного топлива .Катализатор проявляет очень высокую активность в окислении органической фракции (SOF) твердых частиц дизельного топлива. Конверсия SOF может достигать и превышать 80%. При более низких температурах, скажем, 300 ° C, общая конверсия DPM обычно составляет от 30 до 50% (рисунок 3). При высоких температурах, выше 400 ° C, в катализаторе может происходить обратный процесс. Это окисление диоксида серы до триоксида серы, который соединяется с водой, образуя серную кислоту:
Происходит образование твердых частиц сульфата (SO4), что перевешивает выгоду от сокращения SOF.На рис. 3 показан пример ситуации, в которой при 450 ° C общий выброс DPM при неработающем двигателе и катализаторе равен. В действительности образование сульфатов сильно зависит от содержания серы в топливе, а также от состава катализатора. Можно уменьшить выбросы DPM с помощью катализатора даже при высоких температурах, при условии использования подходящего состава катализатора и топлива хорошего качества с низким содержанием серы. С другой стороны, катализатор окисления дизельного топлива , используемый с топливом с высоким содержанием серы, увеличит общий выход DPM при более высоких температурах.Вот почему дизельные катализаторы получают более широкое распространение только после промышленного внедрения дизельного топлива с низким содержанием серы.
Рисунок 3. Каталитическое превращение DPMКатализатор окисления дизельного топлива т, в зависимости от его состава, может также проявлять некоторую ограниченную активность в отношении восстановления оксидов азота в выхлопных газах дизельного двигателя. NO x обычно наблюдаются конверсии 10-20%. Конверсия NO x имеет максимум при температурах среды около 300 ° C.
Катализатор на основе железа может запускать важную реакцию для получения органических соединений
Исследователи из Университета Кейо нашли способ заменить дорогой драгоценный металл рутений (на фото) простым железным катализатором для углеродно-водородного алкилирования ароматических кетонов алкенами. Предоставлено: НАУЧНАЯ ФОТОБИБЛИОТЕКА.Простой железный катализатор может заменить дорогостоящий рутений в реакции, которая может быть использована для создания разнообразных библиотек сложных органических соединений, как показали три исследователя из Университета Кейо1.Это открытие обещает удешевить производство сложных органических молекул, таких как органические электронные материалы и терапевтические препараты.
Органические молекулы состоят в основном из атомов углерода и водорода, а также нескольких других «гетероатомов», таких как азот, кислород или хлор. Химики традиционно использовали реакционную способность этих гетероатомов для создания сложных продуктов из простых исходных молекул.Этот подход, однако, может потребовать длительных последовательностей реакций для установки правильного набора гетероатомов для конкретного превращения, что делает синтез дорогостоящим и трудоемким.
Более эффективный способ создания органических молекул — это прямое управление углеродно-водородными связями молекулы. Эта реакция, известная как функционализация углеродно-водородной связи, включает разрыв связи между углеродом и водородом, а затем замену водорода другим элементом, таким как углерод, кислород или азот.Но поскольку органические молекулы обычно содержат много таких связей, сложно избирательно запустить реакцию только на желаемой связи углерод-водород.
Одним из способов достижения такой селективности является использование катализатора, но часто это дорогие драгоценные металлы, такие как родий, палладий или рутений. Таким образом, существует сильный толчок к замене этих катализаторов из драгоценных металлов более дешевыми катализаторами, сделанными из недорогих металлов, которые имеются в большом количестве, таких как железо.
Итак, Фумитоши Какиучи и его сотрудники Наоки Кимура и Такуя Кочи из Университета Кейо показали, что простое соединение железа катализирует углерод-водородное алкилирование ароматических кетонов алкенами.Соединение железа делает это путем связывания с кетонной группой ароматического кольца, которая направляет входящую молекулу алкена для присоединения к соседнему «орто» положению ароматического кольца. Трио показало, что для этой реакции можно использовать самые разные алкены.
Предыдущие исследования предполагали, что железо могло управлять этим преобразованием, но железо потреблялось в процессе. «Эти предшествующие стехиометрические реакции дали нам подсказки для разработки катализируемого железом орто-селективного углерод-водородного алкилирования ароматических кетонов алкенами», — объясняет Какиучи.
Следующим этапом реакций функционализации углерод-водород является разработка «региоселективных» катализаторов, которые избирательно нацелены на конкретную углерод-водородную связь без необходимости в управляющей группе, такой как кетон. «Региоселективная углеродно-водородная функционализация ароматических соединений без использования направляющей группы все еще довольно сложна», — отмечает Какиучи. «Мы намерены разработать этот тип региоселективной углеродно-водородной функционализации с использованием добавок или лигандов».
Новый катализатор контролирует активацию углеродно-водородной связи
Дополнительная информация: Наоки Кимура и др.Катализируемое железом региоселективное антимарковниковское присоединение C – H-связей в ароматических кетонах к алкенам, журнал Американского химического общества, (2017). DOI: 10.1021 / jacs.7b08385
Предоставлено Университет Кейо
Ссылка : Катализатор, сделанный из железа, может запускать важную реакцию образования органических соединений (2018, 8 марта) получено 23 декабря 2021 г. с https: // физ.org / news / 2018-03-катализатор-железо-важная-реакция-соединения.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Новый способ превратить углекислый газ в уголь может «повернуть вспять часы выбросов» | Наука
Если люди надеются ограничить изменение климата потеплением всего на 2 ° C, у нас есть много работы, говорят ученые: сокращение выбросов, посадка деревьев и очистка от углекислого газа (CO 2 ) с неба с помощью новейшие технологии.Теперь с помощью нового процесса можно преобразовать газообразный CO 2 — продукт сжигания ископаемого топлива — в твердый углерод при комнатной температуре, используя лишь небольшую струйку электричества. Но заставить его работать в масштабах всей планеты будет непростой задачей.
В последние годы исследователи обнаружили несколько твердых металлических катализаторов — соединений, ускоряющих химические реакции, — которые могут превращать CO 2 в твердый углерод. Но они работают только при температуре выше 600 ° C, и для обеспечения такого тепла требуется много энергии и денег.Катализаторы также быстро склеиваются, когда выделяемый ими углерод накапливается, что ограничивает их способность поддерживать реакцию.
Чтобы обойти это, химики Дорна Эсрафилзаде и Торбен Даенеке из Университета RMIT в Мельбурне, Австралия, обратились к новому классу катализаторов, изготовленных из металлических сплавов, которые являются жидкими при комнатной температуре. Один такой катализатор, впервые описанный в публикации Nature Chemistry в 2017 году, состоит из каталитически активного палладия, смешанного с жидким галлием. (Жидкость позволяет палладию продолжать преобразовывать малоценные углеводороды, называемые алканами, в более ценные углеводороды, известные как алкены, без слипания.) Эсрафилзаде, Даненеке и их коллеги хотели посмотреть, будет ли что-то подобное работать с CO 2 .
Сначала они сделали сплав галлия, индия и олова, который является жидким при комнатной температуре и проводит электричество. Они добавили в серебристую смесь немного каталитически активного церия и поместили его в стеклянную трубку вместе с водой, которая помогает преобразовать CO 2 в углерод.
Когда они вставляли проволоку в жидкий металл, часть церия на поверхности жидкости вступала в реакцию с кислородом из окружающего воздуха, образуя ультратонкий слой оксида церия.Но большая часть церия оставалась защищенной жидким металлом. Затем исследователи поместили чистый CO 2 в стеклянную трубку и послали электрический разряд в провод. CO 2 диффундировал в жидкий металл, где металлический церий и электричество преобразовали его в твердый углерод, сообщают сегодня Эсрафилзаде и ее коллеги в Nature Communications .
Исследователи говорят, что точный механизм реакции еще не ясен, но, вероятно, он включает пять отдельных этапов, поскольку церий взаимодействует с кислородом, CO 2 и водой, в конечном итоге выделяя твердый углерод и чистый кислород в качестве единственных побочных продуктов.Большим преимуществом этого нового подхода является то, что цериевый катализатор не склеивается. Вместо этого углерод образует маленькие черные хлопья на поверхности жидкого металла, которые затем отслаиваются и перемещаются по бокам и дну трубки, позволяя каталитической реакции продолжаться.
Берт Векхайзен, химик из Утрехтского университета в Нидерландах, называет эту работу «романом» и «довольно приятным». Он говорит, что произведенный углерод может найти применение в самых разных материалах, таких как электроды батарей, теннисные ракетки, клюшки для гольфа и крылья самолетов.
Большой выигрыш, однако, был бы в том, если бы эту технологию можно было расширить, чтобы высасывать CO 2 из воздуха и постоянно хранить его в твердом состоянии. «Хотя мы не можем буквально повернуть время вспять, превращение углекислого газа обратно в уголь и закопание его обратно в землю немного похоже на перемотку таймера выбросов», — говорит Данеке. Но сначала настольный эксперимент команды, который Эсрафилзаде называет «первым шагом», должен быть продублирован в массовом масштабе. По данным Международного энергетического агентства, только в 2017 году люди выбросили в воздух более 32 миллиардов тонн или гигатонн CO 2 .Преобразование этого количества в твердый углерод по сути воссоздает горы угля, которые шахтеры выкапывают из земли.
«Величина гигатонн делает это пугающим», — написал в электронном письме Дуглас Макфарлейн, еще один соавтор исследования и химик из Университета Монаша в Мельбурне. «Но если экономика станет обнадеживающей… [тогда это] кажется очень возможным».
* Исправление, 26 февраля, 19:20: В первоначальной версии этой истории вместо «церий» использовалось слово «цезий».»Это исправлялось на протяжении всей истории.



