Катализатора выхлопных газов автомобиля, неисправный катализатор, плюсы и минусы катализатора, как поменять катализатор на пламегаситель. Как заменить катализатор на пламегаситель?
Как решить проблемы с загазованностью окружающей среды, каждой страной издаются определенные законы, ограничивающие допустимый уровень загрязнения, создаваемый каждым автомобилей. Чтобы соответствовать данным требованиям, автомобильные производители существенно модернизировали конструкцию автомобильного мотора и топливных систем. Одно из существенных изменений случилось в 1975 году — появилось новое устройство, именуемое каталитическим нейтрализатором (каталитическим преобразователем, конвертером) либо просто катализатором. Его работа основывается на преобразовании токсичных выхлопных газов на безвредные посредством восстановления оксидов азота, а также дожига недогоревших углеводородов и угарного газа. Об этом далее в статье.
Катализатор, устройство как работает
Еще из школьного курса химии мы знаем, что катализатор являет собой вещество, вызывающее ускорение химической реакции, но сам катализатор, при этом, в данной реакции не участвует.
Вообще, каталитический конвертер в своей работе состоит из двух разных типов катализаторов — катализатора окисления и катализатора преобразования. Оба варианта состоят с керамической структуры, которая покрыта металлическим каталитиком, как правило, палладием, платиной и/или родием. Идея основывается на том, чтобы сформировать структуру, предоставляющую в потоке выхлопных газов наибольшую площадь поверхности нейтрализатора и свести к минимуму необходимое количество катализатора, так как стоимость материалов для него немалая.
В некоторых современных преобразователях даже стали применять золото, смешанное со стандартными катализаторами. Стоит золото, кстати, даже дешевле в сравнении с другими перечисленными материалами, однако оно способно увеличить окисление.
Большинство современных иномарок оборудовано трехкомпонентными катализаторами. Это свидетельствует, что они дают возможность снизить количество выбросов трех наиболее вредных веществ — окиси углерода (СО), углеводородов (НС) и оксидов азота (NOx).
Катализатор восстановления — первый этап каталитического преобразователя. Он применяет родий и платину, чтобы помочь снизить выбросы оксидов азота (NOx).
Второй этап каталитического нейтрализатора — катализатор окисления. Он снижает количество несгоревшей окиси углерода и углеводородов при их окислении в нейтрализаторе за счет палладия и платины.
Существует две основные вариации конструкций, применяемых в катализаторах — керамические и сотовые. Большинство автомобилей на сегодняшний день применяют сотовую структуру.
Что касается третьего этапа работы катализатора, то он основывается на системе управления, которая осуществляет контроль над потоком выхлопных газов и применяет эти данные для управления системой впрыска горючего в мотор.
Неисправности и причины поломки катализатора
- Механические повреждения (при ударе), в результате которых произошло разрушение керамической сердцевины.
- Применение некачественного топлива либо отклонения в составе топливно-воздушной смеси. При применении горючего с завышенным содержанием железа, частицы из металла прекращают реакцию нейтрализации.
- Увеличенное содержание углеводородов в выхлопе (не отрегулированный мотор) и чрезмерно обедненная смесь приводят к существенному сокращению срока службы катализатора. Они фактически его уничтожают.
- Проникновение смазочного материала в выпускной тракт влечет за собой запекание данной смазки на рабочей поверхности.
- Как заметили специалисты СТО, при применении горючего с высоким содержанием присадок, которые способны повышать температуру отработавших газов, возможно оплавление сот катализатора и его выход из строя.
- Если для запуска мотора автомобиль тянут на буксире или толкают, есть риск попадания несгоревшего бензина.
 При этом происходит нежелательная химическая реакция, способная привести ко взрыву.
При этом происходит нежелательная химическая реакция, способная привести ко взрыву. - Не менее пагубно воздействует контакт с холодной водой. В процессе преодоления водной преграды жидкость может попасть на нагретый до 900 градусов по Цельсию корпус.
Признаки поломки
- Транспортное средство «тупит», плавают обороты на холостом ходу, автомобиль перестает «тянуть», ухудшаются динамические характеристики, нейтрализатор может раскалиться докрасна (каталитический нейтрализатор забился, то есть снижены пропускные способности отработавших газов).
- Характерное дребезжание и звон (соты катализатора рассыпались).
Катализатор вышел из строя, можно ли его отремонтировать
Если катализатор выйдет из строя, у вас будет два варианта решения проблемы:
- Приобретение и установка нового узла с катализатором. Хотя это довольно дорого, зато в дальнейшем у вас не будет дополнительных проблем, а загрязнение атмосферы будет на минимальном уровне.

- Как вариант, выбивание старого элемента, что влечет за собой такие последствия — увеличение расхода горючего в результате изменения параметров выпускного тракта, потребуется перепрошивка ЭБУ, поскольку в результате удаления катализатора с датчиками кислорода все время будет подаваться сигнал о неисправности системы (постоянно будет гореть «чек»).
Катализатор не подлежит ремонту. Его можно лишь заменить на универсальный либо «родной». Также возможна замена нейтрализатора на пламегаситель.
Новый катализатор, почему он так дорого стоит
Для производства каталитического нейтрализатора применяются драгметаллы — платина, родий, палладий. Поэтому стоимость элемента очень высока. Стоит отметить, что чем выше категория напыления, тем больше применяется драгоценных металлов, то есть чем выше уровень норм, которому соответствует напыление (Евро-2,3,4), тем большее количество драгметаллов требуется для полноценного окисления. Дешевые катализаторы не соответствуют требуемым нормам, в результате чего при установке данного элемента «чек» будет гореть постоянно.
Универсальный катализатор от народных умельцев
Оригинальные катализаторы стоят достаточно дорого, что вынуждает автовладельцев искать другие пути решения проблемы. Некоторые монтируют на свой автомобиль пламегаситель, а некоторые отдают предпочтение универсальному катализатору.
В принципе универсальные катализаторы являются те же самыми устройствами, только в низкой ценовой категории. Как и оригинальные каталитические преобразователи, они бывают керамические и металлические. Последние, при этом, считаются более долговечными. Их работа происходит точно по такому принципу, как и оригинальных катализаторов, поэтому при их применении не требуется перепрошивать бортовой компьютер автомобиля.
Существенный недостаток универсальных катализаторов — их небольшой срок службы. Даже «долговечные» металлические агрегаты редко исправно работают более двух лет. Хотя, как показывает практика, даже этот срок слишком велик. Как правило, уже при прохождении второго технического осмотра уровень пагубных веществ в выхлопных газах превышает норму, что не позволяет пройти контроль технического состояния транспортного средства.
Бывает, что нейтрализатор не справляется с требуемой задачей в результате того, что не может достичь нужной температуры. Поэтому, при снятии показаний уровня СО, попробуйте принудительно его раскочегарить. Катализатор можно привести в рабочее состояние посредством увеличения оборотов мотора, удерживая их на большом уровне (5500-6000 оборотов в минуту) на протяжении нескольких минут. Чаще всего после такой экзекуции катализатор «просыпается», с помощью чего можно получить требуемый уровень выхлопа.
Пламегаситель вместо катализатора
- Чтобы изготовить пламегаситель, вам понадобятся две железные трубы, одна из которых по диаметру должна совпадать с выпускной трубой транспортного средства, а другая — иметь большой диаметр, которая и будет корпусом пламегасителя. Помимо этого, запасаемся простыми кухонными металлическими мочалками.
С помощью обычных кухонных мочалок заполняем пространство между трубами
- Далее по всей площади во внутренней трубе просверливаем отверстия диаметром примерно три миллиметра.

Плотно утрамбовываем металлические мочалки
- Посередине внутренней трубы монтируем шайбу, в которой должно быть отверстие, эквивалентное ⅔ диаметра меньшей (внутренней) трубы.
Готовый пламегаситель
- После этого проталкиваем между двумя трубами металлические мочалки (вроде как надевая их на трубу меньшего диаметра) и плотно утрамбовываем. Заполнить необходимо все пространство. Понадобится примерно 25 мочалок. Затем надрезаем свободный край трубы с большим диаметром, загибаем его и обвариваем.
Достоинства и недостатки пламя гасителя
Преимущества пламегасителя:
- Прирост мощности мотора.
- Гарантия на пламегаситель (при приобретении уже готового пламегасителя, а не сделанного собственноручно).
- Высокая надежность.
- Большой срок службы.
- Невысокая стоимость.
Недостатки пламегасителя:
- Потребность проведения дополнительных мероприятий (установка «обманок», прошивка блока управления).

- Потеря гарантии на транспортное средство (для новых автомобилей).
- В выхлопных газах возрастут показатели вредных веществ.
Обманка лямбда зонда, как обмануть лямбда зонд при замене катализатора на пламегаситель
Механическая обманка кислородного датчикаПри удалении катализатора и монтаже пламегасителя, лямбда-зонд, который расположен возле каталитического нейтрализатора, будет выдавать ошибку о его неисправности. В этом случае, отключение кислородного датчика от проводки транспортного средства не сможет решить проблему. Поэтому, следует или перепрограммировать кислородный датчик под стандарт Евро-2, или установить электронную либо механическую обманку кислородного датчика (контроллер, эмулятор). Обманка ограничивает поток выхлопа к лямбда-зонду и корректирует его работу, учитывая изменившиеся условия работы выхлопной системы. Но, эффективность ее применения работает не на сто процентов, поскольку не на всех автомобилях функции кислородного датчика удается заменить контроллером.
Совет профи: для установки пламегасителя нужен квалифицированный мастер и настройщик системы
Несомненно, пламегаситель можно сделать и установить самостоятельно, однако даже если данное мероприятие пройдет успешно, вам все ровно потребуется обманка каталитического нейтрализатора, а также настройка всей системы. Поэтому лучше доверить это профессионалам, во избежание проблем с выхлопной системой в дальнейшем.
Как работает автомобильный каталитический нейтрализатор?
Во время работы двигателя внутреннего сгорания в атмосферу выбрасываются отработанные газы, которые не только являются одной из основных причин загрязнения воздуха, но и одной из причин многих заболеваний.
Эти газы, которые выходят из выхлопных систем транспортных средств, состоят из чрезвычайно вредных элементов, поэтому современные автомобили оснащаются особенной системой выхлопа, в которой обязательно присутствует катализатор.
Каталитический нейтрализатор разрушает вредные молекулы выхлопных газов и делает их максимально безопасными для людей и окружающей среды.
Что такое катализатор?
Каталитический нейтрализатор представляет собой тип устройства, основной задачей которого является снижение вредных выбросов от выхлопных газов автомобильных двигателей. Устройство катализатора простое. Это металлическая емкость, которая установлена в выхлопной системе автомобиля.
В емкости есть две трубы. «Вход» преобразователя соединен с двигателем, и через него поступают выхлопные газы, а «выход» соединяется с резонатором выхлопной системы автомобиля.
Когда выхлопные газы двигателя попадают в катализатор, в нем происходят химические реакции. Они разрушают вредные газы и превращают их в безопасные, которые можно выбрасывать в окружающую среду.
Из каких элементов состоит каталитический нейтрализатор?
Чтобы было немного понятнее, как работает автомобильный каталитический нейтрализатор, рассмотрим, каковы его основные элементы. Не вдаваясь в подробности, перечислим только основные элементы, из которых он построен.
Не вдаваясь в подробности, перечислим только основные элементы, из которых он построен.
Подложка
Подложка представляет собой внутреннюю структуру катализатора, на которую наносятся покрытие катализатора и драгоценные металлы. Существует несколько типов подложек. Их основное отличие — материал, из которого изготавливается. Чаще всего это инертное вещество, которое стабилизирует на его поверхности активные частицы.
Покрытие
Активный материал катализатора обычно состоит из диоксида алюминия и таких соединений, как церий, цирконий, никель, барий, лантан и другие. Цель покрытия — расширить физическую поверхность подложки и служить в качестве основы, на которую наносятся драгоценные металлы.
Драгоценные металлы
Драгоценные металлы, присутствующие в каталитическом нейтрализаторе, служат для проведения чрезвычайно важной каталитической реакции. Обычно используемые драгоценные металлы — это платина, палладий и родий, но в последние годы большое количество производителей начали использовать золото.
Корпус
Корпус представляет собой внешнюю оболочку устройства и содержит подложку и другие элементы катализатора. Материал, из которого обычно делают корпус — нержавеющая сталь.
Трубы
Трубы соединяют каталитический нейтрализатор автомобиля с выхлопной системой автомобиля и двигателем. Они сделаны из нержавеющей стали.
Как работает автомобильный каталитический нейтрализатор?
Для работы двигателя внутреннего сгорания важно, чтобы в его цилиндрах происходил стабильный процесс сгорания воздушно-топливной смеси. Во время этого процесса образуются вредные газы, такие как оксид углерода, оксиды азота, углеводороды и другие.
Если в автомобиле нет каталитического нейтрализатора, все эти чрезвычайно вредные газы после выброса в выпускной коллектор из двигателя будут проходить через выхлопную систему и будут попадать непосредственно в воздух, которым мы дышим.
Если транспортное средство имеет каталитический нейтрализатор, выхлопные газы будут проходить от двигателя к глушителю через соты подложки и вступать в реакцию с драгоценными металлами. В результате химической реакции вредные вещества нейтрализуются, и из выхлопной системы в окружающую среду попадает лишь безвредный выхлоп, состоящий в большей степени из углекислого газа.
В результате химической реакции вредные вещества нейтрализуются, и из выхлопной системы в окружающую среду попадает лишь безвредный выхлоп, состоящий в большей степени из углекислого газа.
Из уроков химии мы знаем, что катализатор — это вещество, которое вызывает или ускоряет химическую реакцию, не влияя на нее. Катализаторы участвуют в реакциях, но не являются ни реагентами, ни продуктами каталитической реакции.
Есть две стадии, через которые проходят вредные газы в катализаторе: восстановление и окисление. Как это работает?
Когда рабочая температура катализатора достигает от 500 до 1200 градусов по Фаренгейту или 250-300 градусов по Цельсию, происходят две вещи: восстановление, и сразу после этого реакция окисления. Это звучит немного сложно, но на самом деле это означает, что молекулы вещества одновременно теряют и получают электроны, из-за чего меняется их структура.
Восстановление (поглощение кислорода), которое происходит в катализаторе, направлено на превращение оксида азота в экологически чистый газ.
Как работает автомобильный катализатор на стадии восстановления?
Когда закись азота из выхлопных газов автомобиля попадает в катализатор, платина и родий в нем начинают воздействовать на разложение молекул оксида азота, превращая вредный газ в совершенно безвредный.
Что происходит на стадии окисления?
Вторая стадия, которая происходит в катализаторе, называется реакцией окисления, в которой не сгоревшие углеводороды превращаются в диоксид углерода и воду путем смешивания с кислородом (окисление).
Реакции, которые происходят в катализаторе, изменяют химический состав выхлопных газов, изменяя структуру атомом, из которых они состоят. Когда молекулы вредных газов переходят из двигателя в катализатор, он разделяет их на атомы. Атомы, в свою очередь, рекомбинируют в молекулы в относительно безвредные вещества, такие как диоксид углерода, азот и вода, и выбрасываются в окружающую среду через выхлопную систему.
Основными типами каталитических нейтрализаторов, используемых в бензиновых двигателях, являются два: двухсторонний и трехходовой.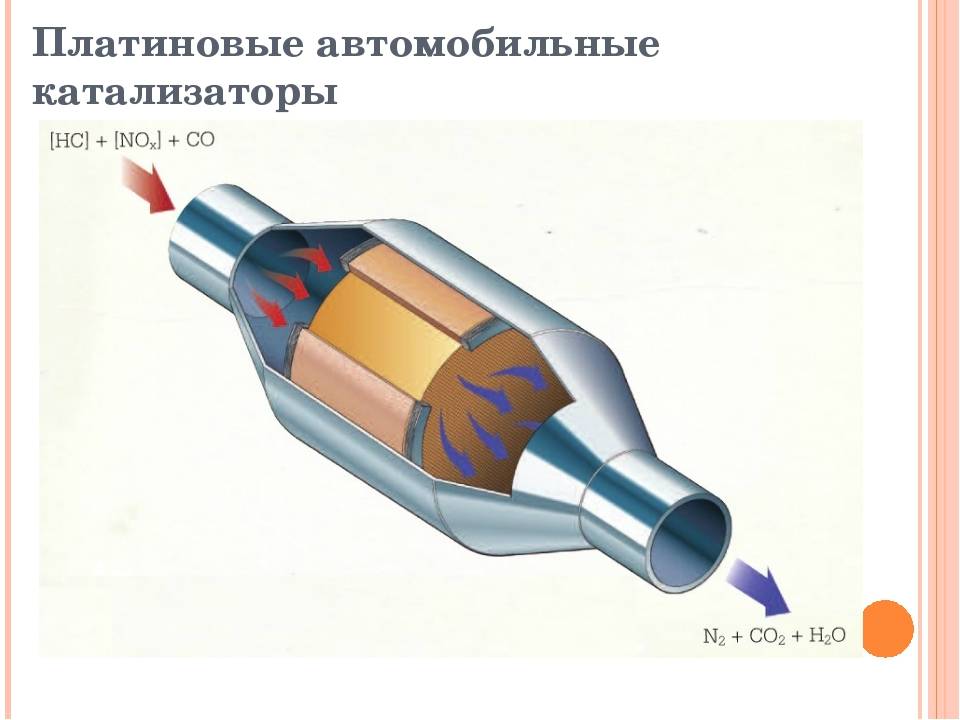
Двусторонний
Двустенный (двухсторонний) катализатор одновременно выполняет две задачи: окисляет окись углерода до двуокиси углерода и окисляет углеводороды (не сгоревшее или частично сгоревшее топливо) до двуокиси углерода и воды.
Этот тип автомобильного катализатора использовался в дизельных и бензиновых двигателях для снижения вредных выбросов углеводородов и окиси углерода до 1981 года, но поскольку он не мог преобразовывать оксиды азота, после 81 года его заменили трехкомпонентными катализаторами.
Трехходовой окислительно-восстановительный каталитический нейтрализатор
Этот тип автомобильного катализатора, как выяснилось, был представлен в 1981 году, и сегодня его устанавливают на все современные автомобили. Трехходовой катализатор выполняет три задачи одновременно:
- восстанавливает оксид азота до азота и кислорода;
- окисляет окись углерода до двуокиси углерода;
- окисляет не сгоревшие углеводороды до углекислого газа и воды.
Поскольку этот тип каталитического нейтрализатора выполняет обе стадии катализа — восстановление и окисление, он выполняет свою задачу с эффективностью до 98%. Это означает, что если ваш автомобиль оснащен таким каталитическим нейтрализатором, он не будет загрязнять окружающую среду вредными выбросами.
Это означает, что если ваш автомобиль оснащен таким каталитическим нейтрализатором, он не будет загрязнять окружающую среду вредными выбросами.
Типы катализаторов в дизельных двигателях
Для дизельных автомобилей до недавнего времени одним из наиболее часто используемых каталитических нейтрализаторов был дизельный катализатор окисления (DOC). Этот катализатор использует кислород в потоке выхлопных газов для преобразования оксида углерода в диоксид углерода и углеводородов в воду и диоксид углерода. К сожалению, этот тип катализатора эффективен только на 90%, и ему удается устранить запах дизеля и уменьшить видимые частицы, но он не эффективен для снижения выбросов NO x.
Дизельные двигатели выделяют газы, которые содержат относительно высокий уровень твердых частиц (сажи), который состоит в основном из элементарного углерода, с которым катализаторы DOC не могут справиться, поэтому частицы должны быть удалены с помощью так называемых сажевых фильтров (DPF).
Как обслуживаются катализаторы?
Чтобы не было проблем с катализатором, важно знать, что:
- Средний срок службы катализатора составляет около 160000 км.
 Проехав это расстояние, вам нужно подумать о замене преобразователя.
Проехав это расстояние, вам нужно подумать о замене преобразователя. - Если автомобиль оснащен каталитическим нейтрализатором, вы не должны использовать этилированное топливо, так как оно снижает эффективность катализатора. Единственное подходящее топливо в этом случае — неэтилированное.
Несомненно, преимущества этих устройств для окружающей среды и нашего здоровья огромны, но в дополнение к их преимуществам у них есть и свои недостатки.
Одним из их самых больших недостатков является то, что они работают только при высоких температурах. Другими словами, когда вы заводите автомобиль, каталитический нейтрализатор почти ничего не делает для уменьшения выхлопных газов.
Он начинает работать эффективно только после того, как выхлопные газы нагреваются до 250-300 градусов по Цельсию. Вот почему некоторые производители автомобилей предприняли шаги для решения этой проблемы путем перемещения катализатора ближе к двигателю, что, с одной стороны, улучшает производительность устройства, но сокращает его срок службы, поскольку его близость к двигателю подвергает его воздействию очень высоких температур.
В последние годы было решено разместить каталитический нейтрализатор под сиденьем пассажира на расстоянии, которое позволит ему работать более эффективно, не подвергаясь воздействию высоких температур двигателя.
Другими недостатками катализаторов являются частое засорение и обжиг пирога. Выгорание обычно происходит из-за не сгоревшего топлива, попадающего в выхлопную систему, которое воспламеняется в подаче катализатора. Засорение чаще всего происходит из-за плохого или неподходящего бензина, естественного износа, стиля вождения и т.д.
Это очень небольшие недостатки на фоне огромных преимуществ, которые мы получаем от использования автомобильных катализаторов. Благодаря этим устройствам ограничиваются вредные выбросы, производимые автомобилями.
Некоторые критики утверждают, что углекислый газ — тоже вредный выброс. Они считают, что катализатор в автомобиле не нужен, так как из-за таких выбросов усиливается парниковый эффект. На самом деле, если автомобиль не имеет каталитического нейтрализатора и выделяет угарный газ в воздух, этот оксид сам превратится в углекислый газ в атмосфере.
Кто изобрел катализатор?
Хотя катализаторы массово не появлялись до конца 1970-х годов, их история началась намного раньше.
Отцом катализатора считается французский инженер — химик Евгений Гудри, который в 1954 году запатентовал свое изобретение под названием «Каталитический нейтрализатор выхлопных газов».
До этого изобретения Гудри изобрел каталитический крекинг, в котором крупные сложные органические химические вещества разделяются на безвредные продукты. Затем он экспериментировал с различными видами топлива, его целью было сделать его более чистым.
Фактическое применение катализаторов в автомобили имело место в середине 1970-х годов, когда были введены более строгие правила контроля выбросов, требующие удаления свинца из выхлопа из-за некачественного бензина.
Вопросы и ответы:
Как проверить наличие катализатора на авто? Для этого достаточно заглянуть под автомобиль. Помимо основного глушителя и малого глушителя (резонатора, который стоит в передней части выхлопной системы), катализатор – еще одна колба.
Где в машине стоит катализатор? Так как катализатор должен работать в условиях с высокой температурой, то он стоит максимально близко к выпускному коллектору. Он находится перед резонатором.
Что такое катализатор в авто? Это каталитический нейтрализатор – дополнительная колба в выхлопной системе. Она заполнена керамическим материалом, соты которого покрыты драгоценным металлом.
ПОХОЖИЕ СТАТЬИ
Как работает каталитический дожигатель?
Каталитические дожигатели, покрытые платиной На дорогах нашей страны миллионы машин, и каждая из них является источником загрязнения атмосферы. В крупных городах больше автомобилей, поэтому их выхлопы могут больше навредить атмосфере.Для решения этой проблемы были приняты законы о контроле над загрязнением воздуха, ограничивающие выброс вредных веществ, производимый автомобилями. За многие годы производители автомобили внесли много изменений в конструкцию двигателей и топливных систем для соответствия требованиям этих законов. Одно из таких изменений относится к 1975 г., когда было представлено интересное устройство под названием каталитический дожигатель выхлопных газов. Каталитический дожигатель предназначен для преобразования вредных веществ в менее вредные до их выхода из выхлопной системы автомобиля.
Одно из таких изменений относится к 1975 г., когда было представлено интересное устройство под названием каталитический дожигатель выхлопных газов. Каталитический дожигатель предназначен для преобразования вредных веществ в менее вредные до их выхода из выхлопной системы автомобиля.
Каталитический дожигатель имеет очень простую конструкцию и огромное значение. В этой статье мы расскажем о том, какие вредные вещества производятся двигателем, и как каталитический дожигатель справляется с ними, снижая выбросы в атмосферу.
Расположение каталитического дожигателя в автомобилеВредные вещества, производимые двигателем
Для того, чтобы уменьшить выброс вредных веществ, двигатели современных автомобилей тщательно контролируют количество сжигаемого топлива. Они стараются поддерживать состав горючей смеси очень близким к стехиометрической точке, т.е. идеальному соотношению воздуха и топлива. В теории, при таком соотношении все топливо сгорает, благодаря кислороду, содержащемуся в воздухе. Для бензина стехиометрическое соотношение составляет приблизительно 14,7:1, т.е. на 1 кг бензина должен приходиться 14,7 кг воздуха. В действительности, во время езды состав топливной смеси немного отличается от идеального соотношения. Иногда смесь может быть бедной (отношение воздуха к топливу выше 14,7) или богатой (отношение воздуха к топливу ниже 14,7).
Для бензина стехиометрическое соотношение составляет приблизительно 14,7:1, т.е. на 1 кг бензина должен приходиться 14,7 кг воздуха. В действительности, во время езды состав топливной смеси немного отличается от идеального соотношения. Иногда смесь может быть бедной (отношение воздуха к топливу выше 14,7) или богатой (отношение воздуха к топливу ниже 14,7).Выбросы двигателя включают следующие вещества:
- Газообразный азот (N2) — воздух на 78% состоит из азота, и большая его часть проходит через двигатель.
- Углекислый газ (СО2) — один из продуктов сгорания. Углерод, содержащийся в топливе, связывается с кислородом из воздуха.
- Пары воды (Н2О) — еще один продукт сгорания. Водород, содержащийся в топливе, связывается с кислородом из воздуха.
По большей части, эти выбросы не являются вредными, хотя считается, что углекислый газ способствует глобальному потеплению. В связи с тем, что процесс сгорания протекает в неидеальных условиях, двигатель также производит небольшое количество вредных выбросов. Каталитический дожигатель предназначен для их нейтрализации:
Каталитический дожигатель предназначен для их нейтрализации:
- Угарный газ (СО) — ядовитый газ без цвета и запаха.
- Углеводороды или летучие органические соединения (ЛОС) образуются из испарений несгоревшего топлива и приводят к возникновению смога.
- Оксиды азота (NO и NO2 или их общее обозначение NOx) приводят к образованию смога и кислотных дождей, которые могут оказывать неблагоприятное воздействие на слизистые оболочки.
Далее мы расскажем о том, что происходит внутри каталитического дожигателя.
Как каталитический дожигатель борется с загрязнением?
В химии катализатором называется вещество, которое вызывает или ускоряет химическую реакцию без его изменения. Катализатор принимает участие в реакции, но не являются ни реагентами, ни продуктами реакции. В теле человека энзимы являются естественными катализаторами, отвечающими за протекание большинства важных биохимических реакций [источник: Chemicool].
В каталитическом дожигателе задействовано два типа катализаторов: восстановительный катализатор и окислительный катализатор. Оба типа состоят из керамической структуры, покрытой металлическим катализатором, обычно платиной, родием и/или палладием. В связи с тем, что материалы являются чрезвычайно дорогими, требуется создать конструкцию, обеспечивающую максимальную площадь контакта катализатора с потоком выхлопных газов при минимальном количестве катализатора. В некоторых новых дожигателях используется смесь золота с более традиционными катализаторами. Золото дешевле других материалов и может повысить окисление — химическую реакцию, снижающую количество вредных веществ до 40% [источник: Kanellos].
Большинство современных автомобилей оснащены трехступенчатыми каталитическими дожигателями. Такая конструкция используется для контроля трех типов загрязняющих выбросов, с которыми борется дожигатель.
На первой ступени дожигателя используется восстановительный катализатор. В катализаторе используется платина и родий, снижающие выброс NOx. При контакте молекул NO и NO2 с катализатором, происходит восстановления кислорода для образования О2. Атомы азота связываются с другими восстановленными атомами азота для образования N2. Пример:
При контакте молекул NO и NO2 с катализатором, происходит восстановления кислорода для образования О2. Атомы азота связываются с другими восстановленными атомами азота для образования N2. Пример:
2NO => N2 + O2 или 2NO2 => N2 + 2O2
2NO => N2 + O2 или 2NO2 => N2 + 2O2
2CO + O2 => 2CO2
В каталитических дожигателях используется два основных типа конструкций — соты и керамическая подложка. В большинстве современных автомобилей используется сотовая конструкция.
Далее мы расскажем о третьей ступени каталитического дожигателя, а также о том, как повысить его КПД.
Борьба с загрязнением и повышение КПД
Третья ступень дожигателя включает систему контроля, которая отслеживает состав выхлопа для управления системой впрыска топлива. В автомобилях имеется датчик кислорода, расположенный ближе к двигателю, чем каталитический дожигатель. Этот датчик отслеживает содержание кислорода в выхлопе и передает информацию на компьютер двигателя. Компьютер двигателя может повышать или понижать содержание кислорода в выхлопе, регулируя отношение воздуха к топливу. Такая схема контроля позволяет компьютеру двигателя обеспечивать работу двигателя максимально приближенно к стехиометрической точке, а также обеспечивать достаточное содержание кислорода в выхлопе для сжигания несгоревших углеводородов и СО с использованием окислительного катализатора.
В автомобилях имеется датчик кислорода, расположенный ближе к двигателю, чем каталитический дожигатель. Этот датчик отслеживает содержание кислорода в выхлопе и передает информацию на компьютер двигателя. Компьютер двигателя может повышать или понижать содержание кислорода в выхлопе, регулируя отношение воздуха к топливу. Такая схема контроля позволяет компьютеру двигателя обеспечивать работу двигателя максимально приближенно к стехиометрической точке, а также обеспечивать достаточное содержание кислорода в выхлопе для сжигания несгоревших углеводородов и СО с использованием окислительного катализатора.Каталитический значительно снижает выброс вредных веществ, но все же его можно существенно улучшить. Недостатком каталитического дожигателя является то, что он работает при достаточно высокой температуре. При холодном запуске двигателя, каталитический дожигатель практически не выполняет свою работу.
Одним из простых решений этой проблемы является установка дожигателя ближе к двигателю. При этом в дожигатель поступают более горячий выхлоп, и дожигатель прогревается быстрее, но эксплуатация при экстремально высоких температурах может сократить срок его службы. Большинство производителей автомобилей устанавливают дожигатель под передним пассажирским сидением, что достаточно далеко от двигателя, чтобы обеспечивать безопасную температуру работы.
При этом в дожигатель поступают более горячий выхлоп, и дожигатель прогревается быстрее, но эксплуатация при экстремально высоких температурах может сократить срок его службы. Большинство производителей автомобилей устанавливают дожигатель под передним пассажирским сидением, что достаточно далеко от двигателя, чтобы обеспечивать безопасную температуру работы.
Предварительный прогрев каталитического дожигателя также позволит снизить выброс вредных веществ. Для прогрева дожигателя проще всего использовать нагреватель с электросопротивлением. К сожалению, 12-вольтные электрические системы большинства автомобилей не обеспечивают достаточную мощность для быстрого прогрева каталитического дожигателя. Большинство водителей не станут ждать несколько минут перед запуском двигателя для прогрева дожигателя. В гибридных автомобилях используются большие высоковольтные аккумуляторы, которые могут обеспечить мощность, достаточную для быстрого прогрева каталитического дожигателя.
Каталитические дожигатели дизельных двигателей практически не справляются с устранением NOx. Это происходит из-за более низкой рабочей температуры по сравнению с бензиновым двигателем, а дожигатели работают лучше при высокой температуре. Некоторые ведущие автомобильные эксперты в сфере защиты окружающей среды разработали решение для этой проблемы. Они вводят раствор мочевины в выхлопную трубу, который испаряется, смешивается с выхлопом и приводит к химической реакции, снижающей выброс NOx. Мочевина, или карбамид, является органическим соединением, состоящим из углерода, азота, кислорода и водорода. Она получается из мочи млекопитающих и земноводных. Мочевина вступает в реакцию с NOx с выделением водяного пара и азота, нейтрализуя более 90% оксидов азота выхлопе [источник: Innovations Report].
Это происходит из-за более низкой рабочей температуры по сравнению с бензиновым двигателем, а дожигатели работают лучше при высокой температуре. Некоторые ведущие автомобильные эксперты в сфере защиты окружающей среды разработали решение для этой проблемы. Они вводят раствор мочевины в выхлопную трубу, который испаряется, смешивается с выхлопом и приводит к химической реакции, снижающей выброс NOx. Мочевина, или карбамид, является органическим соединением, состоящим из углерода, азота, кислорода и водорода. Она получается из мочи млекопитающих и земноводных. Мочевина вступает в реакцию с NOx с выделением водяного пара и азота, нейтрализуя более 90% оксидов азота выхлопе [источник: Innovations Report].
Про катализаторы…: bmwservice — LiveJournal
Вышеупомянутая «трехкомпонентность» подразумевает исключительно три основных полезных реакции:
а) доокисление «угарного газа» до сравнительно безвредной двуокиси углерода;
б) выделение из вредных окислов азота самого атмосферного азота;
в) расщепление углеводородов на двуокись углерода и воду.
Следовательно, говорить о «катализатор работает» можно только по отношению к тем компонентам выхлопа, для которых он собственно и создавался. Катализатор не «дожигает», а только убивается несгоревшими компонентами моторного масла, топлива и прочими сложными формами углеводородов. «Масло жрет, но пока еще не дымит, потому что катализатор еще работает» — абсурд. Так хорошо знакомое владельцам «немцев» сизое дымление говорит не о смерти катализатора, а о проблемах с двигателем, которые таким образом по наследству достаются катализатору и транзитом через него проходят, заодно его добивая. Катализатор же такие эксцессы способен терпеть лишь непродолжительное время. При несвоевременном устранении причин, его активный слой покрывается спекшейся органикой, а сами соты — наглухо забиваются.
Далее логично осветить такой важный момент как срок жизни катализатора. К великому удивлению, при условии исправно работающего двигателя, этот компонент не менее долговечен, чем кузов автомобиля и даже имеет все шансы его пережить. Каталитический нейтрализатор работает без расхода активного вещества.
Каталитический нейтрализатор работает без расхода активного вещества.
Убить катализатор может только неисправность двигателя в некоторых особо заметных проявлениях: моторное масло в выхлопных газах, позднее зажигание и неправильное смесеобразование. Убедиться в этом можно самостоятельно, найдя видавшую виды иномарку ранних выпусков типа BMW E34 года так 1987 и позже — ее катализатор может работать совершенно исправно до сих пор, не в пример современным трех-пятилеткам этого же производителя. А все потому, что моторы типа М50/M20 могут ничего не знать о расходе масла, даже находясь в столь почтенном возрасте…
Катализатор эффективно работает только в диапазоне температур свыше 300 градусов Цельсия. После превышения порога в 900 градусов, он начинает разрушаться. При неудачном стечении обстоятельств (например, разогретый активной ездой катализатор и позднее зажигание от применения 95-го бензина на современном форсированном двигателе, рассчитанном, как правило, исключительно на 98-й) несгоревшее топливо может мгновенно оплавить его например вот так, как на фото:
Следующий важный момент: невероятно распространенная байка про увеличение мощности после удаления катализатора. Если он не оплавлен и сохраняет пропускную способность, «дышать» двигателю он мешает не больше, чем препятствует дыханию вот это приспособление:
Если он не оплавлен и сохраняет пропускную способность, «дышать» двигателю он мешает не больше, чем препятствует дыханию вот это приспособление:
Обращу внимание, что не помогают развеять миф даже популяризованные в легкой и непринужденной манере данные… Полученные, замечу, после очевидной, но несущественной подтасовки. Но даже они дают «разницу» сравнимую с методологической погрешностью измерений (чем, кстати, по сути и являются, что легко понять по видео). Однако полученная разница в плюс-минус 2 л.с. в данном случае, это сравнение не только и не столько исправного катализатора с его отсутствием, сколько исправного с «частично забитым»(sic!).
Кстати, этот эксперимент я проводил лично и на том же стенде. С более «стабильным» результатом — никаким. Удаление полностью исправного и чистого катализатора вообще не дало никакого прироста мощности и мощность стала даже ниже , что объясняется изменившимся условиям в измерительной камере: за пару недель, прошедших после «переварки» катализатора, там немного потеплело. Отмечу, что когда закупорка будет аналогичной вышеприведенной фотографии, двигатель вообще перестанет набирать обороты… Измерять что-либо необходимости не будет.
Отмечу, что когда закупорка будет аналогичной вышеприведенной фотографии, двигатель вообще перестанет набирать обороты… Измерять что-либо необходимости не будет.
Несмотря на вышесказанное, не могу пойти против истины: катализатор все же немного снижает мощность двигателя и тому есть объективная причина. Объяснение лежит в плоскости истории внедрения катализаторов в серийную продукцию. В то время, когда на конвейере одновременно присутствовали «катализаторные» и «бескатализаторные» модели, унификация не позволяла вносить наиболее эффективные технологические изменения в конструкцию выхлопа.
Когда-то, в «переходной период», катализатор был лишь «пришлепкой» на приемной трубе:
Очевидно, что выхлопные газы после почти метрового пробега температуру немало теряли, эффективность нейтрализации снижалась, что заставляло производителя «подтягивать» термостат вверх на десять градусов, что хорошо видно на примере ранних поколений BMW. Температуру двигателя поднимали на 10-15 градусов, что способствует полноте сгорания и улучшает «экологию» вообще.
В следующем поколении двигателей, подтягивали уже не только и не столько температуру (а ее реально подтянули до 100-110 градусов с 90), но и сам элемент катализатора затолкали практически в цилиндр:
Такая конструкция называется «каталитическим коллектором», или же «катколлектором», что мешает настраивать выпускной коллектор на эффект резонанса.
Это дает некоторое сравнительное снижение мощности по сравнению с хорошо настроенными «спортивными» «пауками»:
Так что нужно просто знать, с чем сравнивать.
Но самый главный вопрос, даже при сравнении действительно сравнимых вещей, сколько же реально «съедает» катализатор. Ведь мы меняем рассчитанную и хорошо настроенную систему на кусок полой трубы бОльшего, чем основной, диаметра, где скорость истечения газов падает, а противодавление немного увеличивается!
Дать достаточно точный ответ на этот вопрос нам снова поможет компания BMW, которая (и это также мною проверено на диностенде) всегда исключительно точно указывает мощностные характеристики двигателей. Искушенные читатели сразу поймут, что проще всего будет сравнить «экологичные» версии спортивных моторов BMW S54B32 для американского рынка с европейскими аналогами.
Искушенные читатели сразу поймут, что проще всего будет сравнить «экологичные» версии спортивных моторов BMW S54B32 для американского рынка с европейскими аналогами.
Сначала посмотрим на разницу в конструкции «Европы»:
А катализатора-то там и нет — его перенесли почти на метр… Так что выпуск здесь совершенно «спортивный», а сам кат стоит далеко от двигателя:
А вот версия для США, где катколлектор традиционный, в угоду экологии:
Настало время огласить разницу: установленный катализатор отнял у двигателя… примерно 5 л.с из 343. И целых 10 Н*м крутящего момента.
То есть, отличия настроенной(!) выхлопной системы от «задушенной» катализатором это примерно 2% по мощности и моменту. Это, конечно, можно почувствовать, но очень непросто…
Умелый чип-тюнинг (который и был выполнен самой BMW в версии M3 CSL) даст не менее 5% прибавки и будет стоить дешевле, чем «фирменный» паук и его установка. Следовательно, тупое (самый удачный термин) выбивание катализатора при сохранении катколлектора вообще ничего не даст.
В завершении, предлагаю основные тезисы «про автомобильные катализаторы»:
1.Катализатор — практически вечный прибор, при условии, что двигатель исправен. Должны быть исправны датчики кислорода, должен отсутствовать расход масла, октановое число топлива должно соответствовать режиму эксплуатации и конструкции двигателя. Это минимально достаточные требования для его долговременного функционирования.
2.Удаление катализатора без необходимости — бессмысленная процедура. Не только бесполезная с точки зрения прибавки мощности, но даже вредная — выхлопные газы впрысковых (в т.ч. и непосредственно-впрысковых) автомобилей крайне токсичны и удушливы в виду короткого пути смесеобразования (сравните с хорошо настроенными карбюраторными автомобилями и запахом их выхлопа). При каждом открытии дверей и окон в пробке/стоянке, выхлопные газы будет затягивать в салон по строго законам физики — в зону пониженного давления. Закрытие дверей оставляет вас с ними один на один. Поврежденный катализатор имеет смысл заменить если не на дорогой оригинальный, то хотя бы на универсальный «евро» картридж, немного более низкой эффективности, но и значительно более дешевый. Прошивки типа «евро- 2» также не имеют никакого отношения к увеличению мощности, но негативно сказываются на поддержании оптимального состава смеси — снижают эффективность нейтрализации, даже при условии сохранения катализатора.
Прошивки типа «евро- 2» также не имеют никакого отношения к увеличению мощности, но негативно сказываются на поддержании оптимального состава смеси — снижают эффективность нейтрализации, даже при условии сохранения катализатора.
3.Нормальный выхлоп прогретого автомобиля класса типа «евро-4» и выше — горячий воздух практически без запаха. Во всех случаях отклонений от этой «нормы», стоит задуматься о фактическом состоянии катализатора и двигателя.
4.Данные с датчиков контроля за состоянием катализатора, а также датчиков окислов азота, или температуры катализатора (последние установлены на некоторых азиатских двигателях) — важная информация для автовладельца, которую неплохо бы научиться корректно интерпретировать, что позволит не менять (хуже того — удалять) полностью исправный катализатор в случае возникновения фантомных ошибок (снова см. материал про бензин).
5.Катализатор бессмысленно удалять даже в потенциально «проблемных» по топливу регионах. Металлосодержащие присадки со свинцом и железом и рядом не стояли с воздействием на катализатор, например, того же моторного масла. Ни по эффективности, ни по массово-объемным показателям. Литр масла на 1000 км это просто океан на фоне 1000 л самого злого этилированного бензина. И убить такими присадками катализатор еще сложнее, чем найти такой бензин в крупном городе…
Ни по эффективности, ни по массово-объемным показателям. Литр масла на 1000 км это просто океан на фоне 1000 л самого злого этилированного бензина. И убить такими присадками катализатор еще сложнее, чем найти такой бензин в крупном городе…
Центральная роль ферментов как биологических катализаторов — клетка
Основная задача белков — действовать как ферменты — катализаторы, которые увеличивают скорость практически всех химических реакций внутри клетки. Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками. В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что не могли бы протекать в мягких условиях температуры и давления, совместимых с жизнью.Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, которые без катализа заняли бы годы, могут протекать за доли секунд, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какие из многих возможных химических реакций действительно происходят внутри клетки.
Каталитическая активность ферментов
Как и все другие катализаторы, ферменты характеризуются двумя фундаментальными свойствами.Во-первых, они увеличивают скорость химических реакций, но сами не поглощаются и не изменяются в результате реакции. Во-вторых, они увеличивают скорость реакции, не нарушая химического равновесия между реагентами и продуктами.
Эти принципы ферментативного катализа проиллюстрированы в следующем примере, в котором молекула под действием фермента (называемая субстратом [ S ]) превращается в продукт ( P ) в результате реакции.В отсутствие фермента реакция может быть записана следующим образом:
Химическое равновесие между S и P определяется законами термодинамики (как обсуждается далее в следующем разделе этой главы) и представлено отношением скоростей прямой и обратной реакции ( S → P и P → S соответственно). В присутствии соответствующего фермента превращение S в P ускоряется, но равновесие между S и P не изменяется. Следовательно, фермент должен одинаково ускорять и прямую, и обратную реакции. Реакция может быть записана следующим образом:
Следовательно, фермент должен одинаково ускорять и прямую, и обратную реакции. Реакция может быть записана следующим образом:
Обратите внимание, что фермент ( E ) не изменяется в результате реакции, поэтому химическое равновесие остается неизменным, определяемым исключительно термодинамическими свойствами S и P .
Влияние фермента на такую реакцию лучше всего иллюстрируется энергетическими изменениями, которые должны происходить при превращении S в P ().Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция продолжалась, субстрат должен сначала быть преобразован в более высокое энергетическое состояние, называемое переходным состоянием . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для протекания реакции, ограничивая скорость реакции. Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции. Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Рисунок 2.22
Энергетические диаграммы для катализируемых и некаталитических реакций. Проиллюстрированная реакция представляет собой простое превращение субстрата S в продукт P. Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо. Для (подробнее…)
Каталитическая активность ферментов заключается в связывании их субстратов с образованием комплекса фермент-субстрат ( ES ).Субстрат связывается с определенной областью фермента, называемой активным центром. Связанный с активным центром субстрат превращается в продукт реакции, который затем высвобождается из фермента. Реакция, катализируемая ферментами, может быть записана следующим образом:
Обратите внимание, что E не изменяется в обеих частях уравнения, поэтому равновесие не изменяется. Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут протекать более легко.Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут протекать более легко.Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Механизмы ферментативного катализа
Связывание субстрата с активным центром фермента представляет собой очень специфическое взаимодействие. Активные центры представляют собой бороздки или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, объединенных в третичную структуру свернутого белка.Субстраты первоначально связываются с активным центром посредством нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Как только субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Хотя в простом примере, описанном в предыдущем разделе, использовалась только одна молекула субстрата, большинство биохимических реакций включают взаимодействие между двумя или более различными субстратами. Например, образование пептидной связи предполагает соединение двух аминокислот.Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Например, образование пептидной связи предполагает соединение двух аминокислот.Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Рисунок 2.23
Ферментативный катализ реакции между двумя субстратами. Фермент обеспечивает матрицу, на которой два субстрата соединяются вместе в правильном положении и ориентации для взаимодействия друг с другом.
Ферменты ускоряют реакции также путем изменения конформации их субстратов, приближая их к конформации переходного состояния. Простейшей моделью взаимодействия фермент-субстрат является модель «замок-ключ» , в которой субстрат точно помещается в активный центр (). Однако во многих случаях конфигурации как фермента, так и субстрата модифицируются за счет связывания субстрата — процесс, называемый индуцируемым соответствием . В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние.Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние.Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
Рисунок 2.24
Модели фермент-субстратного взаимодействия. (A) В модели «замок-ключ» субстрат точно соответствует активному центру фермента. (B) В модели индуцированного соответствия связывание субстрата искажает конформации как субстрата, так и фермента.Это искажение (подробнее…)
В дополнение к объединению множества субстратов и искажению конформации субстратов для приближения к переходному состоянию, многие ферменты непосредственно участвуют в каталитическом процессе. В таких случаях специфические боковые цепи аминокислот в активном центре могут реагировать с субстратом и образовывать связи с промежуточными продуктами реакции. Кислые и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Кислые и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Химотрипсин относится к семейству ферментов (сериновых протеаз), которые расщепляют белки, катализируя гидролиз пептидных связей. Реакция может быть записана следующим образом:
Различные представители семейства сериновых протеаз (включая химотрипсин, трипсин, эластазу и тромбин) обладают различной субстратной специфичностью; они преимущественно расщепляют пептидные связи, расположенные рядом с разными аминокислотами. Например, в то время как химотрипсин расщепляет связи рядом с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин.Однако все сериновые протеазы сходны по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три критически важные аминокислоты — серин, гистидин и аспартат, — которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Субстраты связываются с сериновыми протеазами путем встраивания аминокислоты рядом с сайтом расщепления в карман в активном центре фермента ().Природа этого кармана определяет субстратную специфичность различных членов семейства сериновых протеаз. Например, связывающий карман химотрипсина содержит гидрофобные аминокислоты, которые взаимодействуют с гидрофобными боковыми цепями его предпочтительных субстратов. Напротив, связывающий карман трипсина содержит отрицательно заряженную кислую аминокислоту (аспартат), которая способна образовывать ионную связь с остатками лизина или аргинина своих субстратов.
Рисунок 2.25
Связывание субстрата сериновыми протеазами.Аминокислота, примыкающая к расщепляемой пептидной связи, вставляется в карман в активном центре фермента. У химотрипсина карман связывает гидрофобные аминокислоты; связывающий карман трипсина содержит (подробнее. ..)
..)
Связывание субстрата позиционирует расщепляемую пептидную связь рядом с активным центром серина (). Затем протон этого серина переносится в активный центр гистидина. Конформация активного центра способствует переносу протона, поскольку гистидин взаимодействует с отрицательно заряженным аспартатным остатком.Серин реагирует с субстратом, образуя тетраэдрическое переходное состояние. Затем пептидная связь расщепляется, и С-концевая часть субстрата высвобождается из фермента. Однако N-концевой пептид остается связанным с серином. Эта ситуация разрешается, когда молекула воды (второй субстрат) входит в активный центр и обращает предшествующие реакции. Протон молекулы воды переносится на гистидин, а его гидроксильная группа – на пептид, образуя второе тетраэдрическое переходное состояние.Затем протон переносится с гистидина обратно на серин, а пептид высвобождается из фермента, завершая реакцию.
Рисунок 2.26
Каталитический механизм химотрипсина. Три аминокислоты в активном центре (Ser-195, His-57 и Asp-102) играют решающую роль в катализе.
Этот пример иллюстрирует некоторые особенности ферментативного катализа; специфичность фермент-субстратных взаимодействий, расположение различных молекул субстрата в активном центре и участие остатков активного центра в формировании и стабилизации переходного состояния.Хотя тысячи ферментов в клетках катализируют множество различных типов химических реакций, в их работе применяются одни и те же основные принципы.
Коэнзимы
Помимо связывания своих субстратов, активные центры многих ферментов связывают другие малые молекулы, участвующие в катализе. Простетические группы представляют собой небольшие молекулы, связанные с белками, в которых они играют важную функциональную роль. Например, кислород, переносимый миоглобином и гемоглобином, связан с гемом, простетической группой этих белков.Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в специфических типах ферментативных реакций. Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Коэнзимы служат переносчиками нескольких типов химических групп. Ярким примером кофермента является никотинамидадениндинуклеотид ( НАД + ), который функционирует как переносчик электронов в окислительно-восстановительных реакциях (). НАД + может принять ион водорода (Н + ) и два электрона (е — ) с одного субстрата, образуя НАДН. Затем НАДН может отдавать эти электроны второму субстрату, повторно образуя НАД + .Таким образом, НАД + переносит электроны с первого субстрата (который окисляется) на второй (который восстанавливается).
Рис. 2.27
Роль НАД + в окислительно-восстановительных реакциях. (A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
(A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
Несколько других коферментов также действуют как переносчики электронов, а третьи участвуют в переносе множества дополнительных химических групп (e .g., карбоксильные группы и ацильные группы; ). Одни и те же коферменты действуют вместе с множеством различных ферментов, катализируя перенос определенных химических групп между широким спектром субстратов. Многие коферменты тесно связаны с витаминами, которые частично или полностью составляют структуру кофермента. Витамины не требуются бактериям, таким как E. coli , но являются необходимыми компонентами рациона человека и других высших животных, которые утратили способность синтезировать эти соединения.
Регулирование активности ферментов
Важной особенностью большинства ферментов является то, что их активность не постоянна, а может модулироваться. То есть активность ферментов можно регулировать так, чтобы они функционировали надлежащим образом для удовлетворения различных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
То есть активность ферментов можно регулировать так, чтобы они функционировали надлежащим образом для удовлетворения различных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
Одним из распространенных типов регуляции ферментов является ингибирование по принципу обратной связи, при котором продукт метаболического пути ингибирует активность фермента, участвующего в его синтезе.Например, аминокислота изолейцин синтезируется серией реакций, начиная с аминокислоты треонина (). Первый этап пути катализируется ферментом треониндезаминазой, которая ингибируется изолейцином, конечным продуктом пути. Таким образом, достаточное количество изолейцина в клетке ингибирует треониндезаминазу, блокируя дальнейший синтез изолейцина. Если концентрация изолейцина снижается, ингибирование по принципу обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин.Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Рисунок 2.28
Подавление обратной связи. Первый этап превращения треонина в изолейцин катализируется ферментом треониндезаминазой. Активность этого фермента ингибируется изолейцином, конечным продуктом пути.
Ингибирование по принципу обратной связи является одним из примеров аллостерической регуляции, при которой активность фермента контролируется путем связывания небольших молекул с регуляторными участками фермента ().Термин «аллостерическая регуляция» происходит от того факта, что регуляторные молекулы связываются не с каталитическим сайтом, а с отдельным сайтом на белке ( алло = «другой» и стерический = «сайт»). Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента. В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
Рис. 2.29
Аллостерическая регуляция. В этом примере активность фермента ингибируется связыванием регуляторной молекулы с аллостерическим сайтом. В отсутствие ингибитора субстрат связывается с активным центром фермента, и реакция протекает. Связывание (подробнее…)
Активность ферментов также можно регулировать путем их взаимодействия с другими белками и ковалентными модификациями, такими как добавление фосфатных групп к остаткам серина, треонина или тирозина.Фосфорилирование является особенно распространенным механизмом регуляции активности ферментов; добавление фосфатных групп либо стимулирует, либо ингибирует активность многих различных ферментов (). Например, мышечные клетки реагируют на эпинефрин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышения мышечной активности. Расщепление гликогена катализируется ферментом гликогенфосфорилазой, который активируется путем фосфорилирования в ответ на связывание адреналина с рецептором на поверхности мышечной клетки. Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Фосфорилирование белков играет центральную роль в контроле не только метаболических реакций, но и многих других клеточных функций, включая рост и дифференцировку клеток.
Рис. 2.30
Фосфорилирование белков. Некоторые ферменты регулируются добавлением фосфатных групп к ОН-группам боковых цепей остатков серина (как показано здесь), треонина или тирозина. Например, фермент гликогенфосфорилаза, катализирующий превращение (далее…)
Влияние катализаторов на скорость реакции — видео и расшифровка урока
Как работают катализаторы?
Катализатор определяется как химическое вещество, которое принимает участие в химической реакции и влияет на ее скорость, не претерпевая постоянных изменений.Химические катализаторы работают точно так же, как и туннель Моффата. Катализаторы предлагают альтернативный способ добраться из одного места в другое. Важно заметить, что вы все еще начинаете и заканчиваете в одном и том же месте; вы просто идете по более легкому пути туда добраться. Итак, давайте разберемся, как они это делают.
Итак, давайте разберемся, как они это делают.
Вот схема типичной химической реакции:
Наша исходная позиция — реагенты: водород и хлор.Это наша точка А. Заканчиваем в точке Б продукты хлористого водорода. Холм посередине — это энергетический барьер, который мы должны преодолеть, чтобы попасть из пункта А в пункт Б.
Этот холм называется энергией активации , и это энергия, необходимая для инициирования химической реакции. Чтобы произошла любая реакция, вы должны преодолеть этот барьер. Теперь вы можете видеть, что холм довольно крутой, прямо как Скалистые горы. Требуется много энергии, чтобы преодолеть это. Но взгляните на красную линию.Это путь, по которому вы идете с катализатором. Как и в туннеле Моффат, по этому маршруту вы можете гораздо проще добраться из пункта А в пункт Б. Катализированный путь является альтернативным путем с гораздо более низкими затратами энергии. Он имеет меньшую энергию активации, и это ускоряет реакцию.
Он имеет меньшую энергию активации, и это ускоряет реакцию.
Важно понимать, что катализаторы изменяют только энергию активации. Вы доберетесь туда быстрее, но то, где вы начнете и где закончите, точно такое же. Таким образом, хотя катализаторы и принимают участие в реакции, они не изменяются в ходе реакции.
Чтобы лучше понять это, подумайте о туннеле Моффата. Туннель определенно участвует в путешествии из пункта А в пункт Б, потому что через него проходит поезд. Это катализатор, потому что он ускоряет процесс. Но как только поезд прошел, туннель остается прежним; он неизменен. Он готов к прохождению следующего поезда.
Катализаторы, используемые в промышленности
Итак, мы узнали, что катализаторы ускоряют химические реакции, снижая энергию активации.На самом деле, даже небольшое уменьшение энергии активации может резко увеличить скорость реакции. По этой причине вы найдете множество катализаторов, используемых в промышленности.
Катализаторы можно разделить на две основные группы. Гомогенные катализаторы находятся в той же фазе, что и реагенты. Так, например, если реагенты находятся в водном растворе, то же самое и с катализатором. Гетерогенные катализаторы находятся в другой фазе, чем реагенты. Например, твердые катализаторы часто используются для ускорения водных или газообразных реакций.
Гомогенные катализаторы находятся в той же фазе, что и реагенты. Так, например, если реагенты находятся в водном растворе, то же самое и с катализатором. Гетерогенные катализаторы находятся в другой фазе, чем реагенты. Например, твердые катализаторы часто используются для ускорения водных или газообразных реакций.
Теперь рассмотрим конкретное применение катализаторов в промышленности. Катализаторы используются в нефтяной промышленности и приносят много преимуществ. Нефтяная промышленность начинается с нефти. Нефть нельзя использовать прямо из земли, ее необходимо предварительно очистить.
Химики используют различные методы очистки нефти; один из способов взломать его. Крекинг — это расщепление больших молекул на более мелкие. Вы можете себе представить, что это потребует много энергии, и традиционный метод заключается в нагревании молекул до очень высокой температуры. Каталитический крекинг — это процесс, в котором катализаторы используются для расщепления более крупных молекул на более мелкие, но при относительно низких температурах. Использование катализатора предлагает альтернативный путь протекания реакции, и этот альтернативный путь не требует таких высоких температур. В результате снижаются как скорость реакции, так и количество потребляемой энергии. Во всех крупных нефтяных компаниях есть ученые, разработавшие катализаторы крекинга.
Использование катализатора предлагает альтернативный путь протекания реакции, и этот альтернативный путь не требует таких высоких температур. В результате снижаются как скорость реакции, так и количество потребляемой энергии. Во всех крупных нефтяных компаниях есть ученые, разработавшие катализаторы крекинга.
Биологические катализаторы
В природе встречается очень важный класс катализаторов. Ферменты — это биохимические катализаторы, влияющие на скорость реакции. Ферменты очень специфичны, и каждый вид выполняет только одну функцию. Наше тело содержит многие тысячи ферментов, каждый из которых выполняет определенную работу.
Ферменты также очень эффективны, часто ускоряя биохимические реакции настолько, что они происходят в тысячи раз быстрее, чем если бы реакция была некатализируемой. Ферменты необходимы для нашего здоровья, а в некоторых случаях имеют решающее значение для нашего выживания. Часто по названию можно узнать, является ли молекула ферментом. Они имеют тенденцию заканчиваться на «-ase».
Они имеют тенденцию заканчиваться на «-ase».
Одним из распространенных примеров фермента является амилаза, которая присутствует в слюне и расщепляет крахмал до сахара. Другим распространенным ферментом является лактаза, которая используется для переваривания лактозы, сахара, содержащегося в молоке. Причина непереносимости лактозы у некоторых людей в том, что им не хватает этого фермента. Протеаза — это фермент, который помогает нам переваривать белки. Это также один из ферментов, содержащихся в очистителе канализации. И в природе существует гораздо больше ферментов.
Резюме урока
В этом уроке вы узнали, что катализатор — это химическое вещество, которое участвует в химической реакции и влияет на ее скорость, не претерпевая необратимых изменений.Катализаторы работают за счет снижения энергии активации химической реакции. Энергия активации — это энергия, необходимая для инициирования химической реакции. В природе встречаются тысячи катализаторов, и они называются ферментами. Ферменты — это биохимические молекулы, влияющие на скорость реакции. Ферменты очень специфичны и очень эффективны и необходимы для нашего здоровья и выживания.
Ферменты — это биохимические молекулы, влияющие на скорость реакции. Ферменты очень специфичны и очень эффективны и необходимы для нашего здоровья и выживания.
Результаты обучения
После изучения этого урока вы должны уметь:
- Определять катализатор и энергию активации
- Объясните, как работают катализаторы
- Опишите примеры катализаторов, используемых в промышленности, а также биологических катализаторов
Chem4Kids.com: Реакции: Катализаторы и ингибиторы
Катализатор похож на добавление немного волшебства в химическую реакцию. Реакции требуют определенного количества энергии, чтобы произойти. Если у них его нет, да ладно, реакции, вероятно, не произойдет. Катализатор снижает количество необходимой энергии, чтобы реакция могла происходить легче. Катализатор — это энергия. Если вы наполните комнату газообразным водородом (H 2 ) и газообразным кислородом (O 2 ), произойдет очень мало.
 Если вы зажжете спичку в этой комнате (или просто произведете искру), большая часть водорода и кислорода соединится, чтобы создать молекулы воды (H 2 O). Это взрывная реакция. Вы также можете добавить катализатор в эту комнату и запустить одну небольшую реакцию. В этой ситуации вы можете добавить немного палладия (Pd), который будет действовать как катализатор.
Если вы зажжете спичку в этой комнате (или просто произведете искру), большая часть водорода и кислорода соединится, чтобы создать молекулы воды (H 2 O). Это взрывная реакция. Вы также можете добавить катализатор в эту комнату и запустить одну небольшую реакцию. В этой ситуации вы можете добавить немного палладия (Pd), который будет действовать как катализатор. Энергия, необходимая для осуществления реакции, называется энергией активации . Поскольку все движется вокруг, необходима энергия. Энергия, необходимая для реакции, обычно находится в форме тепла.Когда добавляется катализатор, происходит нечто особенное. Может быть, молекула меняет свою структуру. Может быть, этот катализатор заставляет две молекулы соединяться, и они высвобождают тонну энергии. Эта дополнительная энергия может помочь протеканию другой реакции, называемой цепной реакцией . Вы также можете подумать о катализаторе, таком как мост в некоторых случаях. Вместо того, чтобы позволить реакциям протекать таким же (но более быстрым) образом, он может предложить новое направление или химический путь, чтобы пропустить этапы, требующие энергии.
Вместо того, чтобы позволить реакциям протекать таким же (но более быстрым) образом, он может предложить новое направление или химический путь, чтобы пропустить этапы, требующие энергии.
Катализаторы также используются в организме человека. Они не вызывают взрывов, но могут вызвать очень сложные реакции. Они помогают объединяться очень большим молекулам. Есть еще один интересный факт о катализаторах. Вы знаете, что катализаторы снижают энергию активации, необходимую для протекания реакции. Чем ниже энергия активации, тем легче комбинировать продукты. Следовательно, и прямая, и обратная реакции ускоряются. Он изменяет обе скорости и обычно изменяет точку равновесия.
 Без ингибиторов некоторые реакции могли бы продолжаться и продолжаться. Если бы они это сделали, все молекулы были бы израсходованы. Это было бы плохо, особенно для вашего тела.Когда вы смотрите телевизор, у вас нет причин расщеплять сахар с такой же скоростью, как если бы вы занимались спортом.
Без ингибиторов некоторые реакции могли бы продолжаться и продолжаться. Если бы они это сделали, все молекулы были бы израсходованы. Это было бы плохо, особенно для вашего тела.Когда вы смотрите телевизор, у вас нет причин расщеплять сахар с такой же скоростью, как если бы вы занимались спортом. Нация науки: солнечное топливо (видео US-NSF)
Как работает каталитический нейтрализатор?
Ответ: С 1975 года каждый автомобиль, произведенный в США, должен иметь каталитический нейтрализатор. Каталитический нейтрализатор отвечает за контроль вредных выбросов вашего автомобиля.Он расположен в нижней части автомобиля, сразу за двигателем. Разбив его название, мы можем точно проанализировать, какова его функция. Каталитические преобразователи содержат вещества или соединения, такие как платина, родий или палладий, которые действуют как катализаторы и преобразователи. Соединения действуют как катализаторы, потому что они вызывают химическую реакцию, но не меняют своей первоначальной формы. Соединения также действуют как конвертеры, потому что они реагируют и преобразуют вредные газы, такие как окись углерода, углеводороды и оксиды азота, производимые вашим двигателем.Это преобразование в менее вредные газы происходит до того, как они покинут вашу выхлопную систему и попадут в воздух. Каталитические нейтрализаторы содержат сотовые структуры (покрытые крошечными порами), покрытые платиной, родием или палладием в зависимости от стадии катализатора. Выхлопные газы двигателя будут проходить через сотовые конструкции с покрытием и вступать в реакцию с соединениями. Выбросы проходят через две разные стадии катализатора: катализатор восстановления и катализатор окисления.Во время первой стадии катализатора (катализатор восстановления) оксиды азота реагируют с сотовой структурой, покрытой платиной и родием. Когда эти вредные оксиды азота реагируют с катализаторами (платиной и родием), катализаторы удаляют молекулу азота, удерживают ее и высвобождают молекулы кислорода. Затем оставшиеся молекулы азота соединятся с другими молекулами азота и выйдут через выхлопную систему.
Соединения также действуют как конвертеры, потому что они реагируют и преобразуют вредные газы, такие как окись углерода, углеводороды и оксиды азота, производимые вашим двигателем.Это преобразование в менее вредные газы происходит до того, как они покинут вашу выхлопную систему и попадут в воздух. Каталитические нейтрализаторы содержат сотовые структуры (покрытые крошечными порами), покрытые платиной, родием или палладием в зависимости от стадии катализатора. Выхлопные газы двигателя будут проходить через сотовые конструкции с покрытием и вступать в реакцию с соединениями. Выбросы проходят через две разные стадии катализатора: катализатор восстановления и катализатор окисления.Во время первой стадии катализатора (катализатор восстановления) оксиды азота реагируют с сотовой структурой, покрытой платиной и родием. Когда эти вредные оксиды азота реагируют с катализаторами (платиной и родием), катализаторы удаляют молекулу азота, удерживают ее и высвобождают молекулы кислорода. Затем оставшиеся молекулы азота соединятся с другими молекулами азота и выйдут через выхлопную систему. На этом этапе вредные оксиды азота превращаются в безвредные кислород и азот.Во время второй стадии катализатора (катализатор окисления) происходит окисление монооксида углерода и углеводородов. Это означает, что молекулы кислорода будут реагировать с молекулами монооксида углерода и углеводорода. Эти вещества проходят через сотовую структуру, покрытую платиной и палладием, которая действует как катализатор и способствует реакции. На этом этапе очень вредные угарный газ и углеводородные газы преобразуются в менее вредные углекислый газ и пары воды. Каталитические нейтрализаторы также работают рука об руку с системой управления.Эта система управления управляет системой впрыска топлива и отслеживает выбросы, выходящие из двигателя, прежде чем они попадут в каталитический нейтрализатор. Он также содержит датчик кислорода, который определяет, сколько кислорода поступает в выхлопную систему. Кислородный датчик контролирует количество кислорода и сообщает системе впрыска топлива, чтобы увеличить или уменьшить количество кислорода, используемого в топливно-воздушной смеси, используемой для питания двигателя.
На этом этапе вредные оксиды азота превращаются в безвредные кислород и азот.Во время второй стадии катализатора (катализатор окисления) происходит окисление монооксида углерода и углеводородов. Это означает, что молекулы кислорода будут реагировать с молекулами монооксида углерода и углеводорода. Эти вещества проходят через сотовую структуру, покрытую платиной и палладием, которая действует как катализатор и способствует реакции. На этом этапе очень вредные угарный газ и углеводородные газы преобразуются в менее вредные углекислый газ и пары воды. Каталитические нейтрализаторы также работают рука об руку с системой управления.Эта система управления управляет системой впрыска топлива и отслеживает выбросы, выходящие из двигателя, прежде чем они попадут в каталитический нейтрализатор. Он также содержит датчик кислорода, который определяет, сколько кислорода поступает в выхлопную систему. Кислородный датчик контролирует количество кислорода и сообщает системе впрыска топлива, чтобы увеличить или уменьшить количество кислорода, используемого в топливно-воздушной смеси, используемой для питания двигателя. Датчик также следит за тем, чтобы в выхлопной системе было достаточно кислорода для использования каталитическим нейтрализатором на стадии катализатора окисления.
Датчик также следит за тем, чтобы в выхлопной системе было достаточно кислорода для использования каталитическим нейтрализатором на стадии катализатора окисления.
Как катализатор влияет на скорость химических реакций
Нажмите, чтобы оценить этот пост!
[Всего: 1 В среднем: 5]Как работают катализаторы?
Чтобы реагенты реагировали и давали продукт, молекулы реагентов должны иметь пороговую энергию, и количество молекул с этой энергией также должно быть выше порогового значения. Эта конкретная энергия называется Энергией Активации. Только те молекулы из реагентов смогут образовывать продукты, которые имеют энергию выше энергии активации.
Катализатор может катализировать только спонтанные реакции, поскольку он не может изменить свободную энергию Гиббса, ΔG, и, следовательно, не может катализировать неспонтанную реакцию. Катализатор всегда увеличивает скорость реакции; любое вещество, уменьшающее скорость реакции, называется ингибитором. Было замечено, что катализатор не изменяет константу равновесия реакции, а скорее ускоряет обратную, а также прямую реакцию, чтобы быстро достичь равновесия. Катализатор катализирует как прямую, так и обратную реакцию в одинаковой степени, и, следовательно, точка равновесия остается той же самой и достигается быстрее по сравнению с реакцией без него.
Было замечено, что катализатор не изменяет константу равновесия реакции, а скорее ускоряет обратную, а также прямую реакцию, чтобы быстро достичь равновесия. Катализатор катализирует как прямую, так и обратную реакцию в одинаковой степени, и, следовательно, точка равновесия остается той же самой и достигается быстрее по сравнению с реакцией без него.
Они изменяют эту энергию активации или обеспечивают другой механизм реакции, который требует более низкой энергии активации для получения продуктов. Роль катализатора в химических реакциях лучше всего объясняется теорией промежуточных комплексов. Согласно теории промежуточных комплексов, он снижает энергию активации реакции или обеспечивает другой путь реакции, где энергия активации ниже. Он образует временные связи с молекулами реагентов, образуя промежуточный комплекс.Затем этот промежуточный комплекс разлагается с образованием продуктов и катализатора. Катализатор остается одним и тем же до и после реакции. Никаких изменений (химических) в них не наблюдается.
Условия катализа:
Катализаторы – высокоэффективные вещества; небольшое количество катализатора может катализировать большое количество реагентов посредством катализа. Поэтому для разработчиков процессов важно иметь достаточную информацию о катализаторах и роли, которую они играют в изменении скоростей различных реакций.Катализаторы произвели революцию в обрабатывающей промышленности. Большинство отраслей, связанных с производством продуктов и товаров, используют катализаторы для снижения производственных затрат и повышения скорости производства. Даже в нашем организме есть различные типы катализаторов, которые играют важную роль в химических реакциях, происходящих внутри нашего тела, они называются ферментами. Катализаторы играют очень важную роль в современном мире, и, следовательно, некоторые знания о них всегда будут полезны.
Набор задач по энергии, ферментам и катализуЗадача 1 Учебник: Особенности реакций, катализируемых ферментами. Какое утверждение о реакциях, катализируемых ферментами, НЕ верно?
Особенности реакций, катализируемых ферментами. Ферменты являются биологическими катализаторами.Катализаторы снижают энергию активации реакций. Ферменты имеют активные центры. Активный центр фермента — это место на поверхности фермента, где связываются субстраты и где происходит химическая реакция, катализируемая ферментом.Существует точное взаимодействие субстрата, которое происходит в активном центре, стабилизированном многочисленными слабыми взаимодействиями (водородные связи, электростатические взаимодействия, гидрофобные контакты и силы Ван-дер-Ваальса). Ферменты образуют комплексы со своими субстратами. Связывание субстрата с активным центром фермента называется «комплексом фермент-субстрат». Общее уравнение образования комплекса выглядит следующим образом:
Биологический проект Факультет биохимии и молекулярной биофизики Аризонский университет Пересмотрено: октябрь 2004 г. Связаться с отделом разработки Команда http://www.биология.аризона.эду |
GCSE ХИМИЯ — Что такое катализатор? — Как работает катализатор? — Каково определение катализатора?
GCSE CHIMISTRY — Что такое катализатор? — Как работает катализатор? — Каково определение катализатора? — ОГЭ НАУКА.
gcsescience.com 13 наука.ком
Скорости реакции
Что такое катализатор?
Катализатор – это вещество, которое изменяет скорость
реакция.
Катализатор часто используется для ускорения реакции.
Катализатор не участвует в
реакция как реагент.
Он не изменяется в ходе реакции и не расходуется во время реакции.
Он все еще существует в той же форме, когда реакция завершена.
Катализатором может быть переходный металл, оксид переходного металла
(см. Использование переходных металлов) или
фермент. Исключение
оксид алюминия, используемый для крекинга
углеводороды.
Вещество, которое хорошо работает в качестве катализатора для одной реакции
, может не работать в качестве катализатора для другой.
иная реакция.
Как работает катализатор?
Катализатор работает
обеспечивая удобную поверхность, которая
позволяет другой маршрут
для химического
наступить реакция.
Реагирующие частицы
на поверхности катализатора
столкнуться
больше
часто друг с другом и большее количество столкновений
приводит к химической реакции, потому что разные
маршрут
, обеспечиваемый катализатором, имеет более низкую энергию активации.
Катализатор часто используется в качестве мелкодисперсного
порошок так, чтобы в нем было
большая площадь поверхности на
грамм (см. также наночастицы).
Катализаторы
используется для повышения ставок
химических реакций
важны в промышленности
процессов для экономии энергии
и снижения затрат.См. ферменты
и процесс Габера.
Ссылки Катализаторы и энергия Ферменты Вопросы по пересмотру
gcsescience.com Периодическая таблица Показатель Катализатор Викторина gcsescience.com
Дом GCSE Химия GCSE Физика
Авторское право © 2015 gcsescience.
 При этом происходит нежелательная химическая реакция, способная привести ко взрыву.
При этом происходит нежелательная химическая реакция, способная привести ко взрыву.


 Проехав это расстояние, вам нужно подумать о замене преобразователя.
Проехав это расстояние, вам нужно подумать о замене преобразователя.
 K eq зависит только от разницы в уровне энергии между реагентами и продуктами.
K eq зависит только от разницы в уровне энергии между реагентами и продуктами.