Ремонт КПП ВАЗ – лучшая цена. КПП ВАЗ – ремонт и диагностика с Техно-Сервис К
Обслуживание и ремонт КПП ВАЗ или автомобиля ЗАЗ — эти услуги у нас всегда доступны. Мы работаем как с зарубежными, так и с отечественными авто. Работы проводятся опытными специалистами на современном оборудовании с использованием оригинальных запчастей и комплектующих.
Любые манипуляции с коробкой переключения передач начинаем с диагностики:
- Сначала мы проводим визуальный осмотр: проверяем уровень и качество масла, рабочей жидкости, и есть ли дефекты.
- Пробный заезд — оцениваем функциональное состояние КП и каждый режим работы.
- Компьютерная диагностика. Подключаем компьютер, считывающий коды ошибок.
После тщательной проверки трансмиссии проводим ремонт КПП: цена будет разумной и в качестве не возникнет сомнений. Стоимость, варианты ремонтных работ и запчасти — все это обязательно с вами согласуем.
Ремонт КПП ВАЗ
На отечественных авто ВАЗ в основном стоят механические коробки передач, которые нуждаются в регулярном обслуживании.
Длительность ремонтных работ зависит от тяжести поломки, но мы сделаем все возможное для быстрого восстановления коробки. Для этого у нас есть многолетний опыт и необходимое оборудование.
Ремонт КПП ЗАЗ
Механическая трансмиссия ЗАЗа может выйти из строя, как по искусственным, так и по естественным причинам. Для увеличения ее эксплуатационного периода важно регулярно проходить ТО.
Если возникло подозрение на неисправность, обязательно выполните ремонт КПП ЗАЗ — услуга предоставляется недорого в «Техно-Сервис К». Первым делом мы проведем диагностику. Демонтаж и разборка коробки не всегда необходимы, но если поломка серьезная, тогда мы:
- Демонтируем узел и разберем его.
- Промоем детали и заменим масло.
- Восстановим или заменим отдельные детали.

- Выполним сборку.
- Установим и обкатаем механизм.
Все эти процедуры мы выполняем быстро. На проведенные работы предоставляем гарантию.
Ремонтировать КПП у нас — это выгодно
Почему? Мы всегда нацелены на требуемый результат. В процессе работы используем только оригинальные запчасти и применяем узкоспециализированное оборудование. Поврежденную деталь можем принять на ремонт в то время, когда будет удобно именно вам.
Мы работаем с коробками подключения передач любого типа. Проводим ремонт КПП в Симферополе — обращайтесь в любой наш дилерский центр. Звоните и записывайтесь на сервис или просто пишите нам, и мы свяжемся с вами в течение нескольких минут.
Ремонт КПП ВАЗ 5-и ступка нового образца
В данном фотоотчете вашему вниманию представлено подробное описание сборки
Разница с классическими моделями лишь в устройстве привода спидометра.
Описание дефектовки производиться не будет, так как при детальном осмотре шестерен и подшипников и так все будет ясно. Основное внимание будет уделено блокирующему кольцу синхронизатора (в народе синхрон), а также вилки переключения передач.
При ремонте коробке на Ниве могут возникнуть такие вопросы:
1Блокирующее кольцо синхронизатора не должен иметь круговой борозды с торца где зубчики (наличие данного факта свидетельствует, что муфта зубьями достает до блокирующего кольца синхронизатора, что означает, пара не работает конусами). Напыление желтого цвета должно присутствовать на вилках.
Напыление желтого цвета должно присутствовать на вилках.
На фотографии вторичный вал с установленной на него ступицей муфты и муфтой третей-четвёртой передачи, вставляем шестерню третей передачи (все детали при установке необходимо смазывать трансмиссионным маслом).
Шестерня второй передачи.
Ступица муфты.
4

5
Шестерня первой передачи.
Вставляем вторичный вал.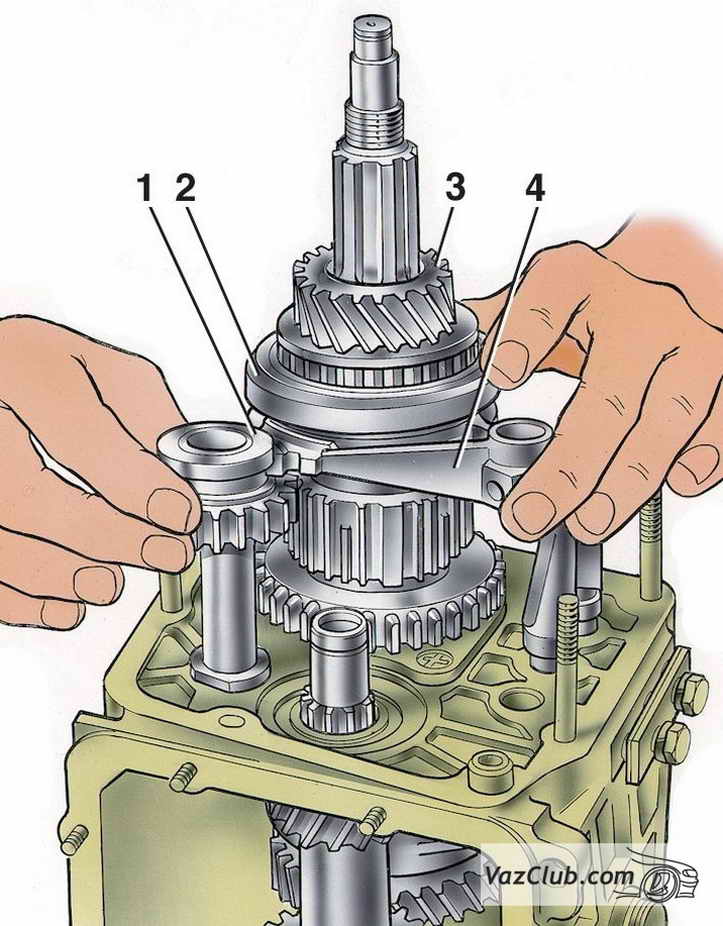
Подшипник вторичного вала
10
На месте посадки игольчатого подшипника не должно быть раковин.
Ролики подшипника — должны иметь зеркальный вид, если темно-матовый — замена!
11
Вставляем первичный вал.
12
Закрепляем вторичный вал.
13
Обязательно должны быть шайбы.
14
Улаживаем вилки.
15
Вставляем кулису первой и второй передачи.
16
Болтом закрепляем вилку.
18
Вставляем длинный бочонок.
19
В горизонтальном положении вставляем ползунок в кулису третей и четвёртой передачи, в вилку вставляем кулису, а уже затем развернуть до совпадения отверстий на вилке, после — закрепить.
Вставить маленький бочонок.
20
Улаживаем промежуточный вал.
22
Вставляем подшипник.
23
Вставляем передний подшипник. После закрепить.
24
Устанавливаем картер сцепления.
25
Собираем заднюю часть коробки передач. Надеть ведомую шестерню задней передачи и шайбу на вал.
26
Одеваем втулку на кулису.
27
Одеваем ступицу муфты пятой передачи и стопорное кольцо.
28
Вставляем вилку с кулисой, муфтой пятой и промежуточной шестерней задней передачи.
29
Упорная шайба(также называют — подшипник скольжения).
30
Шестерня пятой.
32
Блок шестерен задней и пятой передачи — закрепить.
33
Надеть масло отражательную шайбу, втулку и подшипник (к слову, на классических моделях заместо втулки установлена шестерня привода спидометра).
34
После надеть подшипник на блок шестерен.
35
Установить шарики и пружинки (пружинка пятой передачи черного цвета и она длиннее всех), после — прикрутить крышку.
36
На картер сцепления установить коробку передач, после установить заднюю крышку.
38
Прикручиваем крышку, закрепить фланец хвостовика коробки передач.
39
А также эластичную муфту с промежуточным валом.
41
Прикручиваем картер коробки передач и закрутить пробку.
43
Поставить рычаг переключения передач, затем по переключать все передачи.
44
Ставим вилку и нажимной подшипник.
45
Коробка передач готова! Можно устанавливать.
Ремонт коробки передач (МКПП) ВАЗ (LADA) 2114 в Москве
Добросовестное, профессиональное обслуживание механической коробки переключения передач на автомобиле Лада 2114 – вот, что предлагает мастерская «МКПП Ремонт».
Сотрудники автосервиса понимают, что восстановление работоспособности столь сложного и важного узла требует ответственного и комплексного подхода. Они быстро и качественно справятся с задачами любой сложности.
Причины появления неисправностей
Чаще всего поломки МКПП возникают из-за человеческого фактора. Обычно это:
- Нарушение последовательности переключения передач.
- Агрессивная манера вождения.
- Несоблюдение элементарных правил эксплуатации.
- Несвоевременная замена трансмиссионного масла.
К причинам неработоспособности агрегата также относятся:
- Износ деталей.
- Повреждение подшипников, сальников.
- Загрязнение масляного фильтра.
Чтобы выявить и устранить все неисправности, закажите по демократичной стоимости услуги нашей мастерской.
Советы по эксплуатации МКПП
Интересуетесь, как можно надолго продлить срок службы механической коробки передач? Для этой цели необходимо придерживаться несложных и эффективных рекомендаций. Вот они:
- Правильное использование КПП.
- Периодическая замена трансмиссионного масла.
- Использование качественных запчастей (в случае ремонта).
- Профессиональное обслуживание.
Аккуратная, спокойная манера вождения также позволит сохранить механическую коробку переключения передач в исправном состоянии.
Замена масла МКПП на LADA (ВАЗ) 2114
Не знаете, где можно недорого заказать замену масла в МКПП? Воспользуйтесь услугами нашего центра обслуживания автомобилей. Процедура выполняется квалифицированными мастерами, которые располагают всеми необходимыми инструментами и оборудованием. Мы работаем:
- По адекватной цене.
- Оперативно.
- Добросовестно.
- На профессиональном уровне.
- Согласно общепринятым правилам и технологиям.
Комплексный подход к решению проблем дает возможность добиться высокого качества результатов. Мы предлагаем, возможно, самые выгодные условия в Москве.
Хотите проконсультироваться и предварительно записаться на прием к автомеханику? Закажите обратный звонок. Сотрудник автосервиса свяжется с вами в короткие сроки. Он подскажет, сколько стоят услуги, поможет заказать их.
Ремонт КПП и замену сцепления автомобилей ВАЗ
Коробка передач в автомобилях ВАЗ является составляющей трансмиссии транспортного средства, которая предназначена для передачи оптимального значения крутящего момента на выходном валу при любых оборотах. Принцип её работы основан на соединении входного и выходного валов за счёт комбинации шестерён с разными передаточными числами.
При нарушении правил эксплуатации, а также вследствие физического износа деталей коробка передач в автомобилях ВАЗ может сбоить. Так, чаще всего ремонтные работы связаны с заменой подшипников, синхронизаторов или шестерён, а также снижением уровня масла вследствие его вытекания. Неисправная коробка передач исключает достаточный уровень комфортности езды и снижает безопасность управления автомобилем, поэтому любые неполадки этого узла должны оперативно устраняться.
| N | Наименование работ | Модель | Стоимость |
| 1 | С/у коробку передач | 01-07 | 2000 |
| 2 | С/у коробку передач | 08-099 | 2000 |
| 3 | Ремонт коробки | 5000 | |
| 4 | Диск сцепления со снятием коробки | 01-07 | 2500 |
| 5 | Диск сцепления со снятием коробки | 08-099 | 2500 |
| 6 | Диск сцепления со снятием коробки | 2121 | 4000 |
| 7 | Маховик с/у при снятой КПП и сцеплении | 200 | |
| 8 | Трос сцепления | 08-099 | 600 |
| 9 | Трос спидометра | 700 | |
| 10 | Цилиндр привода, выключ. сцепления с/у | 500 | |
| 11 | Регулировка свободного хода сцепления | 200 | |
| 12 | Прокачка сцепления | 200 |
1. Очистите от грязи и вымойте снаружи коробку передач. | 2. Установите коробку передач вертикально вверх. | 3. Отверните шесть гаек крепления задней крышки. | |||
4. Отверните болт крепления и… | 5. …снимите кронштейн троса сцепления. | 6. Аккуратно сбейте ударами резинового молотка заднюю крышку. | |||
Примечание Снимайте уплотнительную прокладку аккуратно, поскольку неповрежденную прокладку при сборке можно установить вновь (к п. 8). | 7. Снимите заднюю крышку с картера коробки передач. | 8. Снимите уплотнительную прокладку. | |||
9. Включите 3-ю или 4-ю передачу. | 10. Отверните болт крепления вилки 5-ой передачи и включите 5-ую передачу. | Примечание Чтобы зафиксировать валы от проворачивания, надо одновременно включить 5-ую передачу и 3-ю либо 4-ую передачу. Чтобы включить 5-ую передачу, переместите вниз муфту синхронизатора вместе с вилкой (болт крепления вилки должен быть вывернут) так, чтобы шлицы муфты вошли в зацепление с зубчатым венцом шестерни (к п. 10). | |||
11. Убедитесь, что валы не проворачиваются. | 12. Расконтрите гайку на вторичном валу. | 13. Отверните гайку на вторичном валу. | |||
Примечание Гайки на валах затянуты большим моментом, поэтому нужно приложить большое усилие для отворачивания (к п. 13). | 14. Расконтрите гайку на первичном валу. | 15. Отверните гайку на первичном валу. | |||
Внимание Снимать синхронизатор надо осторожно. Следите, чтобы муфта синхронизатора не сошла со ступицы: подпружиненные фиксирующие шарики синхронизатора могут рассыпаться (к п. 17). | 16. Подцепите отвертками за ступицу синхронизатор 5-ой передачи… | 17. …и снимите его вместе с вилкой. Выньте вилку из муфты. | |||
18. Снимите блокирующее кольцо синхронизатора 5-ой передачи. | 19. Подцепите отверткой ведомую шестерню 5-ой передачи… | 20. …и снимите ее с вторичного вала. | |||
21. Снимите упорное кольцо игольчатого подшипника. | 22. Снимите игольчатый подшипник шестерни 5-ой передачи. | 23. Подцепите отверткой ведущую шестерню 5-ой передачи… | |||
24. …и снимите ее с первичного вала. | 25. С помощью ударной отвертки отверните четыре винта крепления пластины подшипников. | 26. Снимите пластину подшипников. | |||
27. Подцепите отвертками и снимите втулку игольчатого подшипника 5-ой передачи со вторичного вала. | 28. Снимите упорную шайбу со вторичного вала. | 29. Снимите стопорное кольцо подшипника первичного вала. Для этого подожмите одной отверткой стопорное кольцо к кольцу подшипника, а другой отверткой выведите кольцо из канавки. | |||
30. Аналогичным образом снимите стопорное кольцо подшипника вторичного вала. | 31. Отверните пробку фиксатора. | 32. Осторожно извлеките шарик фиксатора с пружиной. Аналогичным образом извлеките еще два фиксатора. | |||
33. Отверните два болта крепления и… | 34. …снимите заднюю опору силового агрегата. | 35. Отверните пробку фиксатора заднего хода. Наклоните коробку и извлеките шарик фиксатора с пружиной. | |||
36. Отверните 12 гаек и болт крепления картера коробки передач к картеру сцепления. | 37. С помощью большой отвертки аккуратно разъедините картеры сцепления и коробки передач. | Примечание Между картерами есть три места, куда можно вставить отвертку, чтобы не повредить уплотнительную прокладку. Поочередно вставляйте в эти пазы отвертку и аккуратно покачивайте до тех пор, пока картеры не разъединятся. | |||
38. Снимите картер коробки передач. | 39. Отверните болт крепления вилки переключения 1-ой и 2-ой передач. | 40. Приподнимите шток и снимите его вместе с вилкой переключения 1-ой и 2-ой передач. | |||
41. Отверните болт крепления вилки переключения 3-ей и 4-ой передач. | 42. Выведите головку штока из зацепления с рычагом… | 43. …и снимите его вместе с вилкой. | |||
44. Поверните шток вилки 5-ой передачи, выведя его головку из рычага. Выньте шток. | 45. Снимите стопорное кольцо. | 46. Снимите вилку включения заднего хода. | |||
47. Снимите шестерню заднего хода с осью. | 48. Слегка покачивая, выньте одновременно первичный и вторичный валы. | При снятии обоих валов коробки передач внутренние кольца передних подшипников остаются на валах. | |||
49. Выньте ведомую шестерню главной передачи вместе с дифференциалом. | 50. Отверните три болта крепления механизма переключения передач. | 51. Снимите механизм переключения передач. | |||
52. Аккуратно снимите уплотнительную прокладку. Примечание Не повредите уплотнительную прокладку при снятии. Неповрежденную прокладку при сборке коробки передач можно использовать вновь (к п. 52). | 53. Выпрессуйте передний подшипник вторичного вала из картера сцепления. Для этого можно использовать лапку съемника или аналогичный инструмент. Выпрессовывайте передние подшипники первичного вала и сальник только при их замене или замене картера сцепления. | 54. Чтобы заменить передний подшипник первичного вала, выпрессуйте сальник. Невозможно выпрессовать сальник первичного вала, не повредив его. Поэтому при замене подшипника первичного вала вам потребуется новый сальник. | |||
55. Выпрессуйте подшипник внутрь картера, прикладывая усилие к наружному кольцу подшипника. | 56. Выньте магнит из картера сцепления. | 57. Отверните гайку крепления корпуса привода спидометра. | |||
58. Подцепите отверткой корпус… | 59. …и снимите корпус с ведомой шестерней привода спидометра. | Примечание Если в процессе эксплуатации были замечены следы подтекания масла через отверстие для привода спидометра, замените резиновое уплотнительное кольцо на корпусе привода. | |||
60. Выньте из корпуса ведомую шестерню с валом привода спидометра. | 61. Вытолкните уплотнительное кольцо из корпуса привода спидометра. | 62. Выверните из картера коробки передач выключатель света заднего хода. | |||
63. Сдвиньте защитный чехол шарнира тяги привода переключения передач с отбортовки на коробке передач. | 64. Снимите противоположную кромку защитного чехла с фланца шарнира. | 65. Отверните болт крепления шарнира к штоку… | |||
66. …и снимите шарнир со штока. | 67. Снимите со штока защитный чехол. | 68. Отверните болт крепления рычага к штоку переключения передач внутри картера сцепления. | |||
69. Выньте рычаг и шток из картера сцепления. | 70. Если в процессе эксплуатации были замечены следы подтекания масла через отверстие в картере сцепления под шток переключения передач, замените сальник штока. | ||||
Ремонт ВАЗ в Твери — Ком Авто
Автосервис КОМ АВТО Тверь, Никольское, проводит ремонт ВАЗ и техническое обслуживание, в том числе сезонное ТО и предпродажную подготовку. Полный комплекс услуг, в наличии запчасти на автомобили ВАЗ, ЛАДА, ОКА, Samara, НИВА и автомобильная химия. Запчасти ВАЗ на заказ – срок поставки 1 рабочий день.
Ремонт ВАЗ в Твери в автосервисе “Ком Авто” – это гарантия качественного, квалифицированного сервисного обслуживания.
Ответим на ваши вопросы по телефонам в Твери:
8-910-930-85-85
8 (4822) 37-05-50
г.Тверь, с.Никольское, д.4Б
ПРАЙС-ЛИСТЫ НА УСЛУГИ:
Чаще всего наши клиенты заказывают вот такие работы по ремонту автомобилей ВАЗ и ЛАДА:
– капитальный ремонт двигателя,
– ремонт коробки передач (КПП),
– замена сцепления автомобиля,
– замена подвески ВАЗ,
– кузовные работы и т.д.
Имеем возможность восстановить автомобиль полностью “от и до”. Проводим ремонт раритетной техники.
По данным статистики, наибольшей популярностью в настоящее время (2015-2018 годы) пользуются отечественные автомобили марки ВАЗ. И если некоторые модели давно сняты с производства, например, 2101–2107, то модификации 2108 и выше (ВАЗ 2112, ВАЗ 2114, ВАЗ 2115) не теряют своей актуальности и конкурируют, за пределами столиц, с иномарками, типа Рено, КИА и т.п. Отечественные автомобили ВАЗ популярны за счет своей экономичности в плане ремонта и обслуживания. Современные автомобили LADA в ремонте и содержании уже на порядок дороже своих старших братьев. Однако и они имеют своих поклонников среди автомобилистов. В любом случае – ВАЗ – автомобиль экономичный и выносливый, даже несмотря на качество российских дорог.
Если говорить о торговой марке LADA, то нельзя не упомянуть, что на АвтоВазе с 2016 года ведется производство популярных иностранных автомобилей – NISSAN, RENAULT, DATSUN. Автосервис КОМ АВТО обслуживает любые иномарки, в том числе перечисленные выше. Приглашаем на ТО!
Разборка коробки передач (ремонт КПП) Нива ВАЗ 21213, 21214, 2131 lada 4×4
Сливаем масло из коробки передач, снимаем вилку и подшипник выключения сцепления (см. соответствующие разделы).
Демонтируем фланец эластичной муфты с носка вторичного вала (см. тут)… |
…и выключатель фонарей заднего хода . |
Механизм выбора передач можно демонтировать на автомобиле, не снимая коробки передач. Для наглядности эти операции выполняем на снятой коробке передач.
Снимаем манжету механизма выбора передач. |
Устанавливаем рычаг переключения передач в нейтральное положение.
Головкой «на 10» отворачиваем три гайки крепления корпуса рычага переключения передач… |
…и вынимаем механизм выбора передач. |
Соединение уплотнено прокладкой. |
Маркером помечаем взаимное расположение шайб и направляющей пластины механизма. |
Головкой «на 10» отворачиваем две гайки крепления блокировочной пластины заднего хода, удерживая болты ключом той же размерности,… |
…и снимаем блокировочную пластину. |
Отвернув еще одну гайку,…
…снимаем нижнюю шайбу направляющей пластины. |
Вынув одну направляющую планку с двумя пружинами,…
…снимаем направляющую пластину с нижнего конца рычага. |
Снимаем верхнюю шайбу направляющей пластины. |
Снимаем корпус рычага переключения передач. |
Вынимаем из проточек корпуса резиновые уплотнительные кольца болтов. |
Снимаем нижнюю прокладку корпуса шаровой опоры. |
Снимаем фланец с защитным чехлом… |
…и верхнюю прокладку корпуса. |
Щипцами снимаем стопорное кольцо. |
Снимаем шайбу и пружину. |
Снимаем сферическую шайбу… |
…и разъединяем рычаг и корпус шаровой опоры. |
Устанавливаем коробку передач картером сцепления на верстак.
Головкой «на 10» отворачиваем десять гаек крепления нижней крышки коробки передач. |
Снимаем крышку… |
…и уплотнительную прокладку. |
Отверткой через отверстие механизма выбора передач сдвигаем вниз шток вилки включения I–II передач (при этом включается II передача). |
Ключом «на 13» отворачиваем гайку крепления задней крышки, расположенную внутри корпуса коробки. |
Ключом «на 13» отворачиваем пять гаек крепления задней крышки, расположенных снаружи корпуса. |
Постукиваем молотком по приливам крышки, при этом отверткой (или подходящим отрезком трубы при снятом сальнике вторичного вала) удерживаем задний подшипник на вторичном валу. |
Сдвигаем крышку со шпилек и снимаем, поворачивая ее по часовой стрелке (глядя со стороны хвостовика вторичного вала), чтобы исключить задевание крышки за штоки и блок шестерен V передачи и заднего хода. |
Снимаем прокладку крышки. |
Для замены подшипника блока шестерен V передачи и заднего хода…
…поддеваем ролики подшипника отверткой… |
… и вынимаем ролики из сепаратора.
Извлекаем сепаратор. |
Поддев крючком наружное кольцо подшипника,… |
…вынимаем его из гнезда задней крышки. |
Снимаем упорное кольцо заднего подшипника вторичного вала. |
Снимаем наружное кольцо подшипника с сепаратором и роликами. |
Снимаем внутреннее кольцо подшипника. |
Снимаем распорную втулку… |
…и маслоотражательную шайбу. |
Для стопорения валов от проворачивания необходимо включить две передачи. II передача была включена при снятии задней крышки. Перед тем как включить заднюю или V передачи, освобождаем вилку включения этих передач. Для этого…
…ключом «на 10» отворачиваем болт крепления вилки к штоку. |
Нажав отверткой на вилку вниз, включаем заднюю передачу. |
Накидным ключом (головкой) «на 17» отворачиваем болт крепления блока шестерен V передачи и заднего хода. |
Вынимаем болт… |
…и снимаем блок шестерен со шлицев промежуточного вала. |
Зажимаем блок шестерен V передачи и заднего хода в тиски с накладками губок из мягкого металла.
Двумя отвертками спрессовываем внутреннее кольцо подшипника блока шестерен… |
…и снимаем внутреннее кольцо. |
Снимаем втулку шестерни V передачи,… |
…саму шестерню с блокирующим кольцом синхронизатора,… |
…ступицу… |
…и муфту синхронизатора. |
Повернув вилку включения V передачи и заднего хода на штоке к вторичному валу,…
…снимаем промежуточную шестерню задней передачи. |
Накидным ключом «на 13» отворачиваем два болта крепления крышки фиксаторов. |
Снимаем крышку и прокладку. |
Вынимаем пружины фиксаторов (пружина штока V передачи и заднего хода длиннее двух других и имеет темный цвет покрытия). |
Намагниченной отверткой вынимаем все три фиксатора. |
Вынимаем шток включения V передачи и заднего хода с вилкой. |
Снимаем вилку со штока. |
Намагниченной отверткой вынимаем блокировочный сухарь из отверстия картера коробки передач, которое расположено между гнездами картера под штоки V передачи и заднего хода и III–IV передач. |
Снимаем со вторичного вала ведомую шестерню задней передачи. |
Из паза вала вынимаем шпонку. |
Головкой «на 10» отворачиваем болт крепления к штоку вилки включения III–IV передач. |
Вынимаем шток. |
В отверстие штока вставлен блокировочный сухарь,…
…вынимаем его. |
Намагниченной отверткой вынимаем блокировочный сухарь из отверстия картера коробки передач, которое расположено между гнездами картера под штоки I–II и III и IV передач (этот сухарь заметно длиннее сухаря, расположенного между штоком включения V передачи — заднего хода и штоком включения III–IV передач). |
Головкой «на 10» отворачиваем болт крепления к штоку вилки включения I-II передач. |
Вынимаем шток. |
Ударной отверткой с крестообразным наконечником отворачиваем три винта крепления стопорной пластины промежуточного подшипника вторичного вала. |
Винты стопорятся специальными шайбами. |
Снимаем стопорную пластину. |
Накидным ключом «на 19» отворачиваем гайку крепления оси промежуточной шестерни заднего хода, удерживая ось от проворачивания ключом «на 24». |
Вынимаем ось промежуточной шестерни заднего хода. |
Отвернув гайки крепления картера сцепления ,…
…разделяем картеры сцепления и коробки передач. |
Снимаем прокладку. |
Снимаем с первичного вала пружинную шайбу с конической поверхностью (меньшим диаметром она обращена к подшипнику). |
Зажимаем в тиски с накладками губок из мягкого металла шлицевую часть первичного вала.
Накидным ключом «на 19» отворачиваем болт зажимной шайбы переднего подшипника промежуточного вала. |
Снимаем зажимную шайбу подшипника. |
Двумя отвертками поддеваем за установочное кольцо передний двухрядный подшипник промежуточного вала… |
…и снимаем подшипник. |
При снятии подшипника его заднее внутреннее кольцо может остаться на валу.
Двумя отвертками спрессовываем заднее внутреннее кольцо подшипника… |
…и снимаем его. |
Вынимаем упорное кольцо заднего подшипника промежуточного вала. |
Вставив отвертку между торцами подшипника и шестерни I передачи промежуточного вала, сдвигаем задний подшипник. |
Вынимаем наружное кольцо подшипника с сепаратором и роликами. |
Снимаем внутреннее кольцо подшипника с носка вала. |
Сдвинув промежуточный вал назад,… |
…вынимаем его из картера коробки передач. |
Поддев двумя отвертками за установочное кольцо задний подшипник первичного вала,… |
…вынимаем первичный вал в сборе с подшипником и блокирующим кольцом синхронизатора. |
Щипцами разжимаем стопорное кольцо… |
…и снимаем его. |
Снимаем пружинную шайбу. |
Опираем торец наружного кольца подшипника на губки тисков.
Молотком с пластмассовым бойком наносим удары в торец первичного вала… |
…и спрессовываем подшипник. |
Щипцами разжимаем установочное кольцо… |
…и снимаем его. |
Сдвинув блокирующее кольцо синхронизатора, щипцами разжимаем стопорное кольцо… |
…и снимаем его. |
Снимаем блокирующее кольцо… |
…и пружину синхронизатора. |
Блокирующие кольца синхронизаторов других передач снимаются аналогично.
С переднего носка вторичного вала снимаем игольчатый подшипник. |
Снимаем вилки включения I и II, III и IV передач. |
Двумя отвертками поддеваем за установочное кольцо промежуточный подшипник вторичного вала… |
…и снимаем его. |
Наклонив, извлекаем из картера коробки передач вторичный вал в сборе с шестернями, муфтами, ступицами и блокирующими кольцами синхронизаторов. |
Снимаем с задней стороны вала втулку и шестерню I передачи в сборе с блокирующим кольцом. |
Вынимаем втулку из шестерни. |
Снимаем муфту синхронизатора включения I и II передач. |
Снимаем ступицу синхронизатора. |
Снимаем шестерню II передачи в сборе с блокирующим кольцом. |
С переднего конца вторичного вала снимаем муфту синхронизатора III и IV передач. |
Зажав вторичный вал в тиски с накладками губок из мягкого металла,…
…щипцами снимаем стопорное кольцо. |
Снимаем пружинную шайбу (она установлена выпуклой стороной к переднему концу вала). |
Снимаем ступицу синхронизатора III и IV передач… |
…и шестерню III передачи в сборе с блокирующим кольцом синхронизатора. |
Сборку коробки передач проводим в обратной последовательности.
Если при снятии переднего двухрядного подшипника промежуточного вала его заднее внутреннее кольцо осталось на валу, то перед установкой подшипник необходимо собрать. Для этого из наружного кольца подшипника…
…отверткой аккуратно вынимаем сепаратор с шариками… |
…и надеваем его на внутреннее кольцо (снятое с вала). |
Сепаратор с шариками и внутренним кольцом вставляем в наружное кольцо подшипника. |
При сборке первичного вала…
…подходящим отрезком трубы напрессовываем подшипник на вал, опираясь на его внутреннее кольцо. |
После установки в картер коробки передач вторичного и промежуточного валов запрессовываем передний и задний подшипники промежуточного вала, промежуточный подшипник вторичного вала и внутреннее кольцо подшипника блока шестерен.
Наружное кольцо подшипника блока шестерен V передачи и заднего хода…
…запрессовываем инструментальной головкой подходящего размера (отрезком трубы) в гнездо задней крышки. |
Вставляем в наружное кольцо подшипника сепаратор и ролики.
Для предотвращения отворачивания болта крепления блока шестерен V передачи и заднего хода наносим на резьбу болта резьбовой герметик.
Для удобства монтажа задней крышки устанавливаем на вторичный вал задний подшипник в сборе.
Все уплотнительные прокладки желательно смазать тонким слоем силиконового герметика.
При сборке механизма выбора передач наносим на шаровую опору смазку Литол-24.
Металлопротеаза SPRTN / DVC1 управляет репликационно-связанной репарацией перекрестных связей ДНК-белок
Резюме
Цитотоксичность перекрестных связей ДНК-белок (DPC) в значительной степени приписывается их способности блокировать развитие репликации ДНК. DPC часто возникают в клетках либо в результате метаболизма, либо в результате воздействия экзогенных агентов, но механизм репарации DPC до конца не изучен. Здесь мы характеризуем SPRTN как специализированную ДНК-зависимую и связанную с репликацией ДНК металлопротеиназу для репарации DPC.SPRTN расщепляет различные ДНК-связывающие субстраты во время S-фазы прогрессирования и, таким образом, защищает пролиферативные клетки от токсичности DPC. Клетки пациентов с синдромом Руйса-Альфа (RJALS) с моногенными и двуаллельными мутациями в SPRTN являются гиперчувствительными к агентам, индуцирующим DPC, из-за дефекта в развитии вилки репликации ДНК и неспособности устранить DPC. Мы предполагаем, что протеаза SPRTN представляет собой специализированный путь репарации DPC, связанный с репликацией ДНК, необходимый для прогрессирования репликации ДНК и стабильности генома.Дефектный SPRTN-зависимый клиренс DPC является молекулярным механизмом, лежащим в основе RJALS, а DPC вносят вклад в ускоренное старение и рак.
Ключевые слова: SPARTAN / DVC1, ДНК-зависимая металлопротеиназа, репарация перекрестных связей ДНК-белок, репликация ДНК, синдром Руйса-Альфа / СПАРТАНЦА, рак, старение
Введение
Многочисленные эндогенные и экзогенные факторы постоянно атакуют геном, вызывая разнообразие химически различных повреждений ДНК (Lindahl, 1993).Если такие повреждения ДНК не восстанавливать, они приводят к нестабильности генома и гибели клеток (Jackson and Bartek, 2009). Клетки развили множество путей репарации ДНК, специализирующихся на различных типах повреждений ДНК (Friedberg et al., 2006, Lindahl and Wood, 1999). Сшивки ДНК-белок (ДПК) представляют собой пока еще недостаточно изученный тип повреждения ДНК, вызванный ковалентным присоединением белков к азотистым основаниям, сахару или разорванным фосфодиэфирным связям в основной цепи ДНК (Ashour et al., 2015, Tretyakova et al., 2015).Очень мало известно о том, как клетки удаляют DPC и восстанавливают вызванные DPC повреждения ДНК (Barker et al., 2005, Connelly and Leach, 2004, Stingele and Jentsch, 2015, Tretyakova et al., 2015). DPC индуцируются химическими реакциями, катализируемыми продуктами клеточного метаболизма, такими как альдегиды, или экзогенными источниками, включая УФ-свет и ионизирующее излучение (Ide et al., 2011, Shi et al., 2004). Практически любой белок в непосредственной близости от ДНК может образовывать неферментативный DPC в присутствии сшивающего соединения, такого как формальдегид (FA) (Shoulkamy et al., 2012). DPC также индуцируются ферментативно, когда определенные ДНК-связывающие ферменты образуют временные ковалентные взаимодействия с ДНК во время их физиологических реакционных циклов. Наиболее изученными ферментативными DPC являются топоизомеразы 1 и 2α (Topo1 и Topo2α), известные как комплексы расщепления Topo1- или Topo2α (Topo-ccs) (Ashour et al., 2015, Maede et al., 2014). Topo1-ccs или Topo2-ccs удаляются тирозил-ДНК фосфодиэстеразой-1 или -2 (TDP1 или TDP2) после протеолиза Topos на небольшие пептидные фрагменты (максимум 15–108 аминокислот) неизвестным механизмом (Debéthune et al., 2002, Интерталь и Шампу, 2011). Это указывает на существование протеазы, которая обрабатывает Topos выше TDP1 или 2 (Zhang et al., 2006). Несмотря на частое появление эндогенных неферментативных и ферментативных DPC в клетках, механизм удаления DPC все еще в значительной степени неизвестен (Ide et al., 2015).
Исследования на бактериях, дрожжах и высших эукариотах показывают, что несколько канонических путей репарации ДНК, включая эксцизионную репарацию нуклеотидов, гомологичную рекомбинацию и путь репарации анемии Фанкони вместе с протеасомозависимой деградацией белков, участвуют в удалении DPC (Barker et al ., 2005, де Грааф и др., 2009, Накано и др., 2007, Салем и др., 2009). Недавно было показано, что дрожжевая ДНК-зависимая протеаза Wss1 (слабый супрессор smt3) защищает дрожжевые клетки от FA-индуцированной токсичности и, в координации с Tdp1, обрабатывает Topo1-ccs (Stingele et al., 2014).
В настоящее время нам неизвестны какие-либо специализированные пути репарации DPC у многоклеточных животных, хотя удаление DPC важно для прогрессирования репликационной вилки ДНК (Kuo et al., 2007, Reardon et al., 2006). Последние биохимические данные в экстракте яиц Xenopus продемонстрировали, что удаление DPC связано с репликацией ДНК протеасомно-независимым, но зависимым от протеаз образом образом (Duxin et al., 2014). Однако протеаза, необходимая для удаления DPC во время репликации ДНК, оставалась неизвестной (Duxin and Walter, 2015, Reardon et al., 2006).
Синдром Руийса-Алфса (RJALS), также известный как синдром СПАРТАНСКОГО, представляет собой аутосомно-рецессивное заболевание человека, характеризующееся хромосомной нестабильностью, преждевременным старением и ранним началом гепатоцеллюлярной карциномы у детей. RJALS вызывается моногенными и двуаллельными мутациями в SPRTN ( DVC1 ), а единственная миссенс-мутация в предполагаемом домене SprT металлопротеазы (SPRTN Y117C ) является патогенным и ответственным за преждевременное старение и рак печени у людей (Lessel et al. al., 2014, Рамадан и др., 2016). В то время как роль C-концевых доменов SPRTN была подробно охарактеризована в синтезе ДНК трансформации и привлечении к очагам повреждения ДНК, функция домена SprT, локализованного в N-концевой части, полностью неизвестна (Centore et al., 2012, Davis et al., 2012, Ghosal et al., 2012, Mosbech et al., 2012). На клеточном уровне клетки RJALS демонстрируют стресс репликации ДНК, в частности более медленную репликацию и повышенное количество остановившихся вилок и двухцепочечных разрывов ДНК (Lessel et al., 2014).
Учитывая важность SPRTN для стабильности генома и тот факт, что биоинформатический анализ предполагает, что SPRTN и дрожжевая протеаза Wss1 отдаленно связаны с семейством металлопротеаз Zinicin (Stingele et al., 2015), мы спросили, является ли SPRTN металлопротеиназа, отвечающая за восстановление ЦОД.
Здесь мы показываем, что SPRTN представляет собой ДНК-зависимую протеазу, которая защищает пролиферативные клетки человека от токсичности DPC. SPRTN связывается с механизмом репликации ДНК и удаляет DPC во время синтеза ДНК, и, таким образом, RJALS вызывается дефектом в репарации DPC.В целом мы определили механизм удаления DPC из хроматина в клетках человека и подчеркнули важность этого механизма для стабильности генома и его значимость для патогенеза человека при ускоренном старении и канцерогенезе.
Результаты
SPRTN предотвращает накопление эндогенных перекрестных связей ДНК-белок
Чтобы исследовать роль SPRTN в репарации DPC, мы выделили общую геномную ДНК из клеток HeLa и проанализировали количество DPC, используя быстрый подход к восстановлению аддуктов ДНК (RADAR) в сочетании с SDS-PAGE / окрашиванием серебром (A) (Kiianitsa and Maizels, 2013).Выделение ДНК в жестких денатурирующих условиях позволяет нам обнаруживать исключительно белки, сшитые с ДНК (DPC). Изоляты DPC количественно определяли по общему количеству ДНК, чтобы гарантировать равное количество ДНК для анализа DPC, а затем обрабатывали бензоназой для удаления всей ДНК и РНК перед детектированием с помощью SDS-PAGE / окрашивания серебром. Обработка протеиназой К DPC, обработанных бензоназой, подтверждает специфичность окрашивания белков методом окрашивания серебром (рис. S1A). Кроме того, обработка клеток известными агентами, индуцирующими DPC, FA, камптотецином (CPT) или этопозидом (ETO), как и ожидалось, вызывает огромное накопление общих (B) или специфических DPC (рисунок S1B).
SPRTN предотвращает накопление перекрестных связей между базальными ДНК и белками
(A) Схема протокола выделения DPC (RADAR).
(B) Накопление DPC в клетках HeLa после обработки FA (2,5 мМ, 30 мин).
(C) Дефицит SPRTN приводит к накоплению DPC (окрашивание серебром). Показаны профили количественной оценки и клеточного цикла (правые изображения).
(D) Количественное определение изолятов DPC методом осаждения SDS / KCl.
(E) Схема доменов белка SPRTN и предполагаемого активного сайта протеазы.
(F) Схема двуаллельных мутаций SPRTN у пациентов с RJALS.
(G) Общие уровни DPC после эктопической экспрессии SPRTN WT или E112A в Δ-SPRTN клетках HeLa и соответствующая количественная оценка. цельноклеточный экстракт: WCE.
(H) Общие уровни DPC в LCL пациентов с RJALS из семьи B (два пациента; B-II: 1 и B-II: 4) и контрольных LCL (CTR). Показаны профили количественной оценки и клеточного цикла (правое изображение). Среднее ± SEM, n = 3.
См. Также рисунок S1.
Количественный анализ общего количества DPC путем окрашивания серебром в различных клеточных линиях (HeLa, HEK293 и T24) показал, что истощение SPRTN приводит к 2-5-кратному увеличению общего количества белков, ковалентно связанных с ДНК (Рисунки S1C и S1D и данные не показаны).Сходным образом, созданные CRISPR / Cas9 клетки HeLa с частичным нокаутом SPRTN (Δ-SPRTN, Figures S1E – S1G) показали 3–4-кратное увеличение общего количества DPC (C). Накопление DPC, наблюдаемое в Δ-SPRTN клетках, было дополнительно подтверждено анализом преципитации SDS / KCl, косвенным методом выделения DPC (D). Увеличение количества DPC в SPRTN-дефицитных клетках не было связано с различиями в стадиях клеточного цикла (C, S1C и S1D). Чтобы исследовать, играет ли предполагаемый протеазный домен в SPRTN роль в удалении DPC, мы эктопически экспрессировали SPRTN дикого типа (SPRTN WT ) или E112A (SPRTN E112A ), вариант, содержащий изменение глутаминовой кислоты на аланин в прогнозируемом активный центр протеазы (HEXXH, H; гистидин, E; глутаминовая кислота, X; и любая аминокислота; E) в Δ-SPRTN клетках HeLa.Сверхэкспрессия SPRTN WT , но не SPRTN E112A , полностью спасала базальное накопление DPC (G, сравните дорожки 3 и 4). Чтобы исследовать, являются ли линии лимфобластоидных клеток (LCL) RJALS с моногенными и двуаллельными мутациями в SPRTN (F; SPRTN-ΔC / SPRTN Y117C ) также недостаточными в удалении DPC, мы выделили и проанализировали общее количество DPC в этих клетках (H ). Клетки RJALS показали увеличение общего количества DPC в 1,5–2 раза по сравнению с контрольными LCL (H, сравните дорожку 1 с дорожками 2 и 3).
Пути эксцизионной репарации нуклеотидов (NER) и гомологичной рекомбинации (HR) также участвуют в репарации DPC. Однако истощение основных компонентов NER (XPC) и HR (MRE11) малой интерферирующей (si) РНК не привело к увеличению общего количества DPC (рисунок S2A). Точно так же нарушение пути репарации межцепочечных сшивок ДНК, анемия Фанкони, из-за истощения FANCD2 не вызывало накопления DPC по сравнению с контрольными клетками (фигура S2A). В целом, эти результаты показывают, что SPRTN является основным игроком, участвующим в удалении DPC, и, более конкретно, что его предполагаемый активный остаток металлопротеазы (E112) важен для удаления эндогенно возникающих DPC в пролиферативных клетках человека.
RJALS и истощенные SPRTN клетки гиперчувствительны к агентам, индуцирующим DPC.
Мы также спросили, являются ли LCL пациентов RJALS и истощенные siRNA SPRTN клетки HeLa гиперчувствительными к агентам, индуцирующим DPC. Мы использовали FA и метилглиоксаль, которые индуцируют общие DPC (B и данные не показаны), а также CPT и ETO, которые индуцируют специфические ферментативные DPC (рисунок S1B). И клетки пациента RJALS (A), и клетки с истощенным SPRTN (B и S2B) были гиперчувствительны к агентам, индуцирующим DPC. Чтобы проанализировать, как отдельные мутации SPRTN, обнаруженные у пациентов с RJALS, влияют на чувствительность клеток к агентам, индуцирующим DPC, мы создали индуцируемые доксициклином (DOX) и стабильные линии клеток Flp-In HeLa, экспрессирующие ферментативный мертвый белок (E112A) дикого типа (WT), и варианты пациента SPRTN (C – 2H и S2C – S2F).Эктопическая экспрессия SPRTN WT , при которой эндогенный SPRTN был истощен siRNA, нацеленной на 3′-UTR транскриптов SPRTN, спасала гиперчувствительность истощенных SPRTN клеток к FA (D) или CPT (рисунок S2C). Напротив, сверхэкспрессия SPRTN E112A или варианта пациента SPRTN Y117C не способствовала снижению гиперчувствительности к FA (E и 2F, соответственно) или CPT (рисунки S2D и S2E, соответственно). Эктопическая экспрессия усеченного варианта пациента SPRTN-ΔC, который все еще содержит интактный предполагаемый домен металлопротеазы, частично устраняет гиперчувствительность к FA (G) или CPT (рисунок S2F).Обе мутации пациента обладают дефектной способностью защищать клетки от DPC, хотя SPRTN-ΔC в меньшей степени, поскольку LCL RJALS гиперчувствительны к агентам, индуцирующим DPC (A).
RJALS и SPRTN-истощенные клетки гиперчувствительны к DPC-индуцирующим агентам
(A) Анализы жизнеспособности клеток RJALS (B-II: 1 и B-II: 4) и контрольных (CTR) LCL после обработки указанными химическими веществами.
(B) Анализ клоногенной выживаемости контрольных siRNA (CTR) или клеток HeLa, истощенных siRNA SPRTN, после обработки указанными химическими веществами.
(C) Схема экспериментальной установки для анализов клоногенной выживаемости в линиях клеток HeLa, индуцируемых доксициклином (+ Dox) SPRTN Flp-In.
(D – G) Эктопическая экспрессия SPRTN WT (D), SPRTN E112A (E), SPRTN Y117C (F) и SPRTN-ΔC (G) после истощения эндогенного SPRTN.
(H) Вестерн-блоттинг (WB) демонстрирует истощение и / или сверхэкспрессию SPRTN. Среднее ± SEM, n = 3.
См. Также рисунок S2.
Затем, чтобы выяснить, вызвана ли цитотоксичность, наблюдаемая в SPRTN-дефицитных клетках, накоплением DPC, мы совместно истощили Topo1 и SPRTN и контролировали выживаемость клеток после лечения CPT.Совместное истощение Topo1 полностью спасло чувствительность к CPT в SPRTN-истощенных клетках (рисунок S2G), подтверждая, что CPT-индуцированная токсичность в SPRTN-истощенных клетках обусловлена накоплением Topo1-ccs. Совместное истощение TDP1, ключевого игрока в удалении Topo1-cc, не приводит к дальнейшей гиперчувствительности SPRTN-истощенных клеток к CPT, предполагая, что оба белка работают по одному и тому же пути (рис. S2H).
Известно, что путь анемии Фанкони защищает от токсичности, вызванной формальдегидом. Как и ожидалось, инактивация пути анемии Фанкони истощением миРНК FANCD2 вызывает гиперчувствительность клеток к лечению FA, но не к лечению CPT (рисунок S2I).Это также свидетельствует о том, что путь анемии Фанкони строго участвует в репарации перекрестных связей между нитями ДНК (также индуцированных обработкой FA), но не в перекрестных связях ДНК-белок (например, удаление специфического DPC, индуцированного CPT). В целом эти результаты предполагают, что SPRTN формирует уникальный путь репарации ДНК для удаления DPC.
SPRTN является ДНК-зависимой металлопротеазой
В результате интенсивной работы нескольких лабораторий не удалось идентифицировать активность протеазы SPRTN (Davis et al., 2012, Kim et al., 2013, Mosbech et al., 2012). Наши результаты заставили нас переоценить опубликованные данные и исследовать, действительно ли SPRTN является протеазой. С этой целью мы очистили SPRTN WT , SPRTN E112A , два варианта пациентов (SPRTN Y117C и SPRTN-ΔC) и несколько вариантов SPRTN, усеченных на С-конце, с использованием системы экспрессии белка E. coli .
Учитывая, что домен SprT классифицируется как предполагаемый домен металлопротеиназы, мы сначала проанализировали присутствие металла в белке SPRTN.Мы очистили SPRTN без C-концевого Zn-связывающего домена UBZ и PIP-бокса (SPRTN 1-268) и проанализировали его с помощью масс-спектрометрии. Анализ интактного белка SPRTN в нативных и денатурирующих условиях показал увеличение массы на 126 дальтон, что соответствует присутствию двух ионов цинка (рисунок S3A). Недавнее открытие, что дрожжевой протеазе Wss1 необходима ДНК для проявления протеолитической активности (Balakirev et al., 2015, Stingele et al., 2014), привело нас к исследованию, связывает ли SPRTN ДНК. Мы использовали двухцепочечные ДНК-зонды (дцДНК) длиной 63 п.н., меченные флуоресцеинизотиоцианатом (FITC), для анализа аффинности связывания SPRTN по поляризации флуоресценции.Белок SPRTN WT показал высокое сродство к дцДНК (константа диссоциации [K D ] ≈100 нМ) (A). Анализ in silico вторичной структуры SPRTN выявил наличие пяти участков связывания ДНК: четырех мотивов в С-концевой части белка и одного в протеазном домене SprT (B и S3B). Удаление предсказанных C-концевых участков связывания ДНК сильно снижает аффинность связывания ДНК SPRTN (A).
SPRTN представляет собой ДНК-зависимую металлопротеиназу с аутопротеолитическими свойствами
(A) Анализ связывания ДНК флуоресцентной поляризацией SPRTN и его усеченных на С-конце вариантов.
(B) Схема предсказанных in silico областей связывания ДНК (зеленые квадраты) в белке SPRTN и в вариантах SPRTN, усеченных на С-конце.
(C) Аффинность связывания ДНК SPRTN WT , SPRTN E112A и SPRTN Y117C по отношению к ds, ss и расширенной ДНК.
(D) ДНК индуцирует аутопротеолиз SPRTN. Мутация E112A или 1,10 фенантролин (фен) подавляет активность SPRTN. Расщепление анализировали на гелях SDS-PAGE и визуализировали окрашиванием кумасси синим.
(E) WB, иллюстрирующий авторасщепление SPRTN.
(F) WB общих клеточных лизатов после эктопической экспрессии FLAG-SPRTN (WT или E112A) после обработки FA. Антифосфо (P) Chk2 представляет собой положительный контроль для активации передачи сигналов повреждения ДНК.
(G и H) Ферментативные реакции in vitro, как в (D), с указанными мутациями пациента.
(I) Количественная оценка активности авторасщепления. Среднее ± стандартное отклонение, n = 3.
См. Также рисунок S3.
Затем мы спросили, связывает ли SPRTN разные структуры ДНК.SPRTN WT связывает одноцепочечную ДНК (оцДНК), дцДНК и расщепленную ДНК с аналогичным сродством (С). SPRTN E112A и SPRTN Y117C проявили сходное сродство к ДНК, что и SPRTN WT . Укороченный вариант SPRTN-ΔC (1-246) показал пониженное сродство к ДНК (K D ≈ 0,48 мкМ; A), что коррелирует с потерей предполагаемых сайтов связывания ДНК (B и S3B).
Мы наблюдали повышенные уровни деградации SPRTN WT , когда реакцию SPRTN и ДНК инкубировали в течение более длительного периода времени и анализировали с помощью SDS-PAGE / окрашивания кумасси синим.Полноразмерный белок SPRTN WT был в основном интактным и имел прогнозируемый размер 55 кДа (D, дорожка 1). Однако инкубация SPRTN WT с дцДНК индуцировала сильную деградацию SPRTN с несколькими видимыми полосами белка и заметным накоплением фрагмента ~ 25 кДа (D, дорожка 2). Масс-спектрометрический анализ продуктов деградации SPRTN WT идентифицировал по крайней мере пять различных продуктов расщепления в белке SPRTN (фигура S7C) с сайтами расщепления, расположенными в его C-концевой части (фигура S3C).Активность авторасщепления SPRTN WT ингибировалась в присутствии 1,10 фенантролина, известного ингибитора Zn 2+ -зависимых металлопротеиназ (D, дорожка 3). Активность авторасщепления SPRTN была отменена мутацией E112A (D, дорожка 5). Вестерн-блот-анализ продуктов авторасщепления SPRTN WT с антителами, индуцированными против N- или C-концевых фрагментов SPRTN, дополнительно подтвердил данные масс-спектрометрии и продемонстрировал, что белок SPRTN в основном расщеплялся в его C-концевой части, в то время как N-концевой фрагмент остался в основном неповрежденным (E, дорожки 2 и 5).Эти данные предполагают, что SPRTN является ДНК и Zn-зависимой протеазой, которая обладает активностью авторасщепления in vitro. SPRTN WT , но не SPRTN E112A , продукты авторасщепления также были видны в клетках HEK293, особенно после обработки FA, демонстрируя активность авторасщепления SPRTN in vivo (F).
Мы также спросили, какова минимальная длина ДНК, необходимая для активации активности расщепления SPRTN (рисунок S3D). Зонды оц- или дцДНК разного размера инкубировали с белком SPRTN WT .Фрагменты ДНК 100-мерной оцДНК или дцДНК были наиболее эффективными активаторами активности авторасщепления SPRTN.
Чтобы исследовать, являются ли мутации пациентов RJALS дефектными в отношении их активности авторасщепления, мы протестировали два варианта пациентов, SPRTN Y117C и SPRTN-ΔC (G – 3I). SPRTN-ΔC продемонстрировал активность авторасщепления, аналогичную SPRTN WT , тогда как SPRTN Y117C показал снижение активности авторасщепления на ~ 80% по сравнению с SPRTN WT (I).Учитывая, что SPRTN Y117C связывает ДНК со сродством, аналогичным SPRTN WT , мы заключаем, что его ферментативный дефицит не связан с нарушением связывания ДНК. Наши результаты показывают, что SPRTN Y117C напрямую влияет на активный центр протеазы (E112), который расположен всего в пяти аминокислотах выше мутации. SPRTN-ΔC (1-246) все еще сохраняет активность авторасщепления, аналогичную SPRTN WT (H и 3I), несмотря на его более низкое сродство к ДНК (A).
Активность транс-расщепления металлопротеиназы SPRTN
Чтобы выяснить, происходит ли авто-расщепление SPRTN в цис или транс , мы инкубировали SPRTN WT с ферментативно мертвым вариантом SPRTN (SPRTN ) E112A E112A .SPRTN WT расщепил SPRTN E112A (Рисунок S3E, сравните дорожки 2 и 4). Эти данные предполагают, что SPRTN расщепляет себя на транс . Чтобы проверить важность связывания ДНК для активности транс-расщепления, мы инкубировали два усеченных на С-конце варианта SPRTN, которые имеют среднее (SPRTN 1-268 ) или низкое (SPRTN 1-218 ) сродство к ДНК с SPRTN . E112A (A для сродства к ДНК). SPRTN 1-268 расщепил SPRTN E112A с эффективностью, аналогичной SPRTN WT (рисунок S3E, сравните дорожку 4 с дорожкой 6).Напротив, SPRTN 1-218 заметно потерял активность транс-расщепления (рисунок S3E, сравните дорожку 4 с дорожкой 8). Затем мы спросили, является ли ДНК каркасом или аллостерическим активатором активности авторасщепления SPRTN. Активность авторасщепления SPRTN WT была максимальной при эквимолярных концентрациях белка и ДНК в реакции. Повышение концентрации ДНК постепенно подавляло активность SPRTN (рисунок S3F). В целом эти результаты показывают, что ДНК служит каркасом, который сближает SPRTN и его субстрат, а не действует как аллостерический активатор.Потеря его C-концевых участков связывания ДНК делает SPRTN неспособным выполнять свою протеолитическую активность, что позволяет предположить, что ауто-расщепление снижает протеолитическую активность расщепленных форм.
Идентификация субстратов SPRTN
Мы выделили DPC из контрольных и истощенных SPRTN клеток HeLa (рис. S4A) и проанализировали их с помощью безметки количественной масс-спектрометрии. Три независимых эксперимента выявили 84 значительно увеличенных (в 1,5 раза) белков в DPC в SPRTN-истощенных клетках по сравнению с контрольными клетками (рисунок S4B и репозиторий исходных данных: PRIDE).Хотя многие из идентифицированных субстратов были ДНК- и РНК-связывающими белками, большинство из них не были ДНК-связывающими белками (рис. S4C). Учитывая, что любой белок в непосредственной близости от ДНК может быть сшит, особенно белки ядерного матрикса, это неудивительно. Соответственно, белки, не связывающие ДНК, такие как Lamin B1 и DNA-PK, обогащены DPC, выделенными из Δ-SPRTN клеток (G).
Удаление DPC во время S-фазы клеточного цикла
(A) Схема экспериментального подхода, используемого для синхронизации клеток T24 в G0 и мониторинга уровней DPC во время входа в S-фазу.
(B) Общие уровни DPC в G0-, поздней G1- и S-фазе до и после истощения SPRTN в клетках HeLa, визуализированные с помощью окрашивания серебром. WB циклина A и профили клеточного цикла использовали в качестве контроля входа в S-фазу.
(C) WB показывает экспрессию SPRTN или истощение в нерепликативных и репликативных клетках Т24.
(D) Схема измерения жизнеспособности репликативных и нерепликативных клеток.
(E) Жизнеспособность репликативных и нерепликативных клеток T24 после истощения SPRTN и обработки FA.
(F) Общие уровни DPC после высвобождения G1 / S в клетках HeLa WT и Δ-SPRTN, визуализированные окрашиванием серебром. WB циклинов и профили клеточного цикла (нижние изображения) использовали для контроля прогрессирования S-фазы.
(G) WB, показывающий присутствие ДНК-PK и ламина B1 в DPC в Δ-SPRTN клетках HeLa после высвобождения G1 / S. Экстракт цельных клеток: WCE. Среднее ± SEM, n = 3.
Мы сосредоточились на гистонах и ДНК-топоизомеразах, ДНК-связывающих белках с хорошо охарактеризованными клеточными функциями, которые оказались среди лучших хитов (≥1.98-кратное увеличение) в нашем масс-спектрометрическом анализе (рисунок S4D). Чтобы подтвердить данные масс-спектрометрии, мы проанализировали конкретные DPC, выделенные, как показано на A, методом иммунодетекции слот-блоттингом. Истощение SPRTN двумя разными миРНК значительно увеличивало количество Topo1, Topo2α, гистона h4 и гистона h5 (A и 4B). Чтобы продемонстрировать, что гипераккумуляция Topo1 специфична для потери активности протеазы SPRTN, мы эктопически экспрессировали SPRTN WT или SPRTN E112A в клетках, нацеленных на 3′-UTR siRNA, истощенных SPRTN.Эктопическая экспрессия SPRTN WT , но не SPRTN E112A , спасала накопление Topo1 (Topo1-cc) (рисунок S4E). Мы дополнительно проанализировали Topo1-ccs после лечения CPT (C). И SPRTN-истощенные клетки, и LCL пациентов накапливают больше Topo1-ccs по сравнению с контрольными клетками, что дополнительно подтверждает фундаментальную важность активности протеазы SPRTN в удалении Topo1-ccs и защите от цитотоксичности DPC (Рисунки S2B – S2H).
Идентификация субстратов SPRTN
(A) Слот-блоты, показывающие присутствие DPC Topo1, Topo2α, h4 и h5 после истощения SPRTN в клетках HeLa и соответствующие количественные оценки.Среднее значение ± SEM, n = 3.
(B) контроли загрузки ДНК для анализа DPC, до обработки бензоназой, как в (A).
(C) Слот-блоты, показывающие накопление Topo1-ccs после непрерывной обработки CPT, как указано, в Δ-SPRTN клетках (левое изображение) и LCL RJALS (правое изображение).
(D) WB и соответствующая количественная оценка, показывающая, что SPRTN расщепляет гистон h4 в присутствии ДНК. Среднее ± стандартное отклонение, n = 3.
(E) Временная кинетика расщепления h4 по сравнению с саморасщеплением SPRTN в одних и тех же реакционных смесях, выраженная как увеличение расщепления h4 или SPRTN с течением времени (мин).Среднее ± SD, n = 3.
(F) Сравнение времени, реакции расщепления h4 для SPRTN WT и SPRTN-ΔC, как в (D). Ось y была нормализована по шкале от 0% до 100%. Среднее ± SD, n = 3.
(G) Гистон h4, Topo1 и Topo2α являются субстратами протеазы SPRTN. Продукты расщепления ( * ) были обнаружены WB с использованием антител против гистона h4 (верхнее изображение), Topo2α (среднее изображение) или Topo1 (нижнее изображение). FL, полная длина.
(H) Множественное выравнивание последовательностей продуктов расщепления гистонов (CP), показывающее сайты расщепления (стрелка) в их неструктурированных N-концевых хвостах ( * обозначает альтернативные продукты расщепления).
См. Также рисунки S4 и S5.
Характеристика ферментативной активности SPRTN
Чтобы охарактеризовать способность SPRTN расщеплять идентифицированные субстраты, мы провели анализы активности расщепления in vitro с использованием очищенного белка SPRTN WT . SPRTN WT расщеплял все тестируемые гистоны, h3A, h3B, h4 и h5, ДНК-зависимым образом, но не цитозольный белок глутатион-S-трансферазу (D, S5A и S5B). Кинетический анализ авторасщепления SPRTN и расщепления гистона h4 в одной и той же реакции показал, что SPRTN расщепляет h4 с немного более быстрой кинетикой, чем он сам (E).Это говорит о том, что SPRTN одновременно расщепляет субстраты и себя, но с более высоким предпочтением субстрату. Это, скорее всего, приводит к инактивации SPRTN, поскольку расщепленные продукты SPRTN теряют аффинность связывания ДНК (A), ферментативную активность (рисунок S3E) и имеют в 2 раза более низкую кинетику процессивности субстрата (F). Это может быть одним из механизмов, помимо регуляции клеточного цикла (см. Ниже), с помощью которого протеаза SPRTN саморегулируется, чтобы предотвратить вредное и неконтролируемое расщепление в непосредственной близости от нее.
Затем мы протестировали активность расщепления различных вариантов SPRTN, уделяя особое внимание гистону h4 (D и 4G). Как и ожидалось, каталитически неактивный SPRTN E112A не расщеплял гистон h4. Подобно активности авторасщепления SPRTN, вариант пациента SPRTN Y117C сильно пострадал в отношении расщепления гистона h4 (~ 8% активности), тогда как SPRTN-ΔC сохранил активность, аналогичную SPRTN WT . Мы распространили анализ активности расщепления на два других идентифицированных субстрата, Topo1 и Topo2α.С этой целью мы очистили YFP-Topo1 и GFP-Topo2α из экстрактов целых клеток в денатурирующих условиях и инкубировали их с различными вариантами SPRTN. SPRTN WT , но не SPRTN E112A , расщеплял Topo1 и Topo2α in vitro, тем самым подтверждая, что Topo1 и Topo2α являются субстратами SPRTN (G, дорожки 2 и 3). Характеристика мутаций пациентов показала, что SPRTN Y117C не может расщеплять Topo1 и Topo2α. Неожиданно, в отличие от авторасщепления (H) и расщепления гистона h4 (D и 4G), SPRTN-ΔC показал сильно сниженный протеолиз Topo1 и Topo2α in vitro, аналогично наименьшей авторасщепленной форме SPRTN (1–227). ) (G, дорожки 5 и 6).Эти данные показывают, что протеаза SPRTN расщепляет различные ДНК-связывающие субстраты ДНК-зависимым образом. Активности протеазы SPRTN серьезно препятствует мутация Y117C пациента для всех тестируемых субстратов. Укороченный пациентом вариант SPRTN-ΔC, хотя и способен расщеплять сам себя и гистон h4, проявляет сильно сниженную активность по отношению к Topo1 и Topo2α, предполагая, что С-концевая часть SPRTN необходима для оптимального протеолиза этих субстратов.
SPRTN — плейотропная протеаза для ДНК-связывающих белков
Затем мы стремились идентифицировать сайты расщепления протеазой SPRTN и спросили, расщепляется ли протеаза SPRTN по конкретному мотиву аминокислотной последовательности.Продукты расщепления h3A, h3B, h4 и h5, а также продукты авто-расщепления SPRTN анализировали с помощью масс-спектрометрии для идентификации сайтов расщепления (H и S5C). Мы обнаружили, что SPRTN расщепляет гистоны h3A, h3B, h4 и h5 в пределах их неструктурированного, положительно заряженного N-концевого хвоста. Все идентифицированные области расщепления были обогащены остатками аргинина и лизина и в большинстве случаев находились в очень непосредственной близости от остатков серина. Анализ сайтов авторасщепления SPRTN (CS) также показал обилие остатков лизина, аргинина и серина (CS 1 и 3), в то время как, в частности, CS3 сильно обогащен серинами (и, в меньшей степени, лизинами и аргининами) ( Рисунок S3C).Подобно сайтам расщепления гистонов, которые присутствуют в неупорядоченных областях белка (N-конец), SPRTN расщепляет себя во многих местах на своем С-конце, который преимущественно неупорядочен (рисунок S5D). Эти результаты предполагают, что SPRTN не является протеазой, специфичной для последовательности, а расщепляет неструктурированные белковые области вблизи остатков лизина, аргинина и серина.
Чтобы проверить, расщепляет ли SPRTN также DPC in vitro, мы выделили общие DPC с помощью анализа преципитации SDS / KCl и инкубировали их с рекомбинантным SPRTN.SPRTN WT , но не SPRTN E112A , расщепляет DPC in vitro (рисунок S6A). На данный момент наши результаты in vitro и in vivo предполагают, что SPRTN расщепляет ДНК-связывающие белки независимо от их статуса связывания с ДНК (т.е. ковалентные DPC или нековалентные). Чтобы дополнительно проверить это наблюдение, мы выделили связанный с хроматином Topo1 или Topo2 в денатурирующих условиях как из необработанных клеток HEK293, так и из клеток, обработанных CPT или ETO, соответственно. Эффективность расщепления SPRTN иммуноочищенных Topo1 и Topo2α была сходной для необработанных и обогащенных Topo1 / 2α-cc образцов (обработанных CPT и ETO, соответственно; Фигуры S6B и S6C).В целом, эти данные предполагают, что SPRTN не специфически расщепляет DPC, а ДНК-связывающие субстраты, и что SPRTN действительно является плейотропной протеазой, поскольку он расщепляет большинство высокомолекулярных DPC in vitro (рисунок S6A, сравните дорожки 1 и 2). .
SPRTN удаляет DPC во время S-фазы и защищает пролиферативные клетки от DPC-индуцирующих агентов
Учитывая, что экспрессия SPRTN отсутствует в G1-фазе клеточного цикла и быстро активируется, когда клетки входят в S-фазу (Mosbech et al. al., 2012), мы предположили, что SPRTN участвует в удалении DPC во время синтеза ДНК. Чтобы проверить эту гипотезу, мы проанализировали уровни DPC во время S-фазы прогрессирования в контрольных и истощенных SPRTN клетках. Мы использовали клетки Т24, которые останавливаются в фазе G0 за счет контактного ингибирования при 100% конфлюэнтности и синхронно входят в S-фазу при разведении до более низких плотностей. Клетки задерживали в G0, обрабатывали контрольной миРНК или SPRTN-миРНК в течение 2 дней, а затем разбавляли для перехода в S-фазу (А). Мы контролировали общее количество эндогенных DPC во время прогрессирования S-фазы.DPC быстро удаляли по мере прохождения контрольных клеток через S-фазу. Напротив, клетки, истощенные SPRTN, показали замедленную кинетику удаления DPC во время S-фазы прогрессирования (B, сравните дорожки 2 и 3 с 5 и 6). Вестерн-блот-анализ клеток T24 показал, что SPRTN не экспрессируется в клетках G0 (C), что дополнительно указывает на важную роль SPRTN в защите от DPC во время синтеза ДНК. Чтобы исследовать эту гипотезу, мы обрабатывали G0-арестованные или пролиферативные клетки T24 контрольными или siRNA SPRTN в течение 2 дней, подвергали клетки воздействию сублетальной дозы FA в течение дополнительных 2 дней, а затем контролировали жизнеспособность клеток (D).Действительно, только пролиферативные клетки с истощенным SPRTN, но не G0-арестованные клетки, были гиперчувствительными к FA (E). Кроме того, Δ-SPRTN клетки HeLa в огромной степени накапливают общие DPC во время прогрессирования S-фазы по сравнению с контрольными клетками (F). Эти данные показывают, что SPRTN обрабатывает DPC во время S-фазы прогрессирования, таким образом защищая клетки от цитотоксичности DPC.
SPRTN является составной частью механизма репликации ДНК
Продемонстрировав, что SPRTN защищает пролиферативные клетки человека от DPC, и зная, что мутация пациента SPRTN Y117C важна для невозмущенного прогрессирования вилки репликации ДНК (Lessel et al., 2014), мы спросили, является ли SPRTN частью механизма репликации ДНК. Мы изолировали SPRTN-SSH из общих экстрактов клеток HEK293 над стрептактин-сефарозой в условиях высокого содержания соли и детергента, чтобы удалить все неспецифические связывающие белки из SPRTN-комплексов in vivo. SPRTN совместно осаждается с основными компонентами механизма репликации ДНК: PCNA, субъединицы 2 и 6 комплекса поддержания минихромосом (MCM) и ДНК-полимераза δ (A). Затем мы спросили, присутствует ли SPRTN физически на сайтах вилок репликации ДНК.Чтобы ответить на этот вопрос, мы выделили белки из зарождающейся ДНК с помощью технологии iPOND. Подобно PCNA, MCM3 и ДНК-полимеразе δ, SPRTN присутствовал на формирующейся ДНК (B, дорожка 2) и перемещался вместе с реплисомой, как показано тимидиновой погоней (B, дорожка 3). В целом эти данные предполагают, что SPRTN является частью механизма репликации ДНК и перемещается вместе с реплисомой во время синтеза ДНК.
SPRTN является частью механизма репликации ДНК и регулирует прогрессию вилки репликации ДНК
(A) CoIP SPRTN-Strep-Strep-His (SSH) из клеток Flp-In HEK293, стабильно экспрессирующих SPRTN при индукции Dox, демонстрируя связь с реплисомой белки.
(B) Схема подхода iPOND (верхнее изображение). iPOND демонстрирует, что SPRTN движется вместе с реплисомой. Клетки HEK293 обрабатывали EdU в течение 10 мин для мечения растущей ДНК (дорожка 2), а затем гнали тимидином, где указано (зрелая ДНК, дорожка 3).
(C) iPOND, демонстрирующий повышенное удерживание белков реплисом на зрелой ДНК в Δ-SPRTN клетках HeLa (дорожки 6 и 7).
(D) Анализ волокон ДНК в клетках HeLa после сверхэкспрессии FLAG-SPRTN WT или пустого вектора FLAG.Показаны типичные волокна ДНК (верхнее изображение). Показана количественная оценка длины IdU-меченного тракта в присутствии агентов, индуцирующих DPC (50 мкМ FA, 25 нМ CPT). Цифры (зеленые) — средние значения длины тракта в килобазах.
(E) Анализ ДНК-волокон в LCL RJALS (B-II: 1) и контрольных LCL после обработки FA или CPT, выполняемой как в (D).
(F) Количественная оценка фокусов 53BP1 в положительных по циклину А клетках HeLa WT или Δ-SPRTN после обработки FA (50 мкМ). Данные представляют кратное изменение в фокусах 53BP1 по сравнению с необработанными клетками (момент времени 0) (верхнее изображение).Показаны репрезентативные микрофотографии фокусов 53BP1 в положительных по циклину клетках через 6 часов после обработки FA (нижнее изображение). Среднее ± SEM, n = 3.
См. Также рисунок S6.
SPRTN управляет прогрессией вилки репликации ДНК путем удаления DPC.
Мы также спросили, влияет ли инактивация SPRTN на развитие механизма репликации ДНК. Мы изолировали вилки репликации ДНК с помощью iPOND и наблюдали за их развитием в контрольных и Δ-SPRTN клетках HeLa (C). Нокаут SPRTN серьезно повлиял на прогрессию репликации ДНК, как показано удержанием PCNA и MCM3 на зрелой ДНК (тимидиновая погоня, C, сравните дорожки 3 и 4 с дорожками 6 и 7).Дефекты в развитии вилки репликации ДНК в клетках Δ-SPRTN были продемонстрированы с помощью анализа волокон ДНК (рис. S6D). Замедленные вилки репликации ДНК в Δ-SPRTN-клетках накапливали Topo1 (рис. S6E), один из субстратов протеазы SPRTN in vitro и in vivo. Эти результаты показывают, что SPRTN регулирует прогрессию реплисом и предотвращает накопление Topo1 в сайтах вилок репликации ДНК. Мы также спросили, взаимодействует ли SPRTN физически с Topos. С этой целью мы совместно осаждали SPRTN, как описано ранее, и анализировали присутствие Topo1 и Topo2α в комплексе SPRTN.Эксперименты по совместной иммунопреципитации показали, что SPRTN действительно образует комплекс как с Topo1, так и с Topo2α in vivo (рисунок S6F).
Чтобы исследовать, как DPC влияют на развитие репликации ДНК, мы использовали анализ волокон ДНК (D). Обработка контрольных клеток низкой дозой FA или CPT вызвала сильное снижение синтеза ДНК, обнаруживаемое как снижение скорости вилки репликации ДНК, когда второй нуклеотид (IdU) инкубировали вместе с FA или CPT. Эктопическая экспрессия SPRTN WT устраняла DPC-индуцированный дефект прогрессии репликационной вилки ДНК как в контрольных, так и в Δ-SPRTN клетках (D и S6D).Измеряя скорость вилки репликации ДНК в LCL RJALS, мы обнаружили, что клетки RJALS показали более сильное снижение (~ 2,5 раза) прогрессии вилки репликации ДНК, чем контрольные клетки при заражении FA или CPT (E). В целом, эти результаты предполагают, что SPRTN важен для прогрессирования вилок репликации ДНК, зараженных DPC-индуцирующими агентами, и является ограничивающим фактором в этом процессе, поскольку снижение скорости вилки в контрольных клетках, обработанных FA / CPT, или клетках Δ-SPRTN может быть восстановлено с помощью Сверхэкспрессия SPRTN WT .
SPRTN предотвращает DPC-индуцированные DSB в S-фазе
Мы предположили, что снижение скорости вилок репликации ДНК в SPRTN-истощенных клетках или клетках RJALS в присутствии агентов, индуцирующих DPC, приводит к длительному задержанию реплисом и, как следствие, к ДНК. коллапс репликационной вилки, визуализируемый как ds-разрывы ДНК (DSB), фенотип, наблюдаемый у пациентов с RJALS (Lessel et al., 2014). Мы непрерывно подвергали контрольные или Δ-SPRTN клетки мягким дозам FA или CPT и контролировали образование фокусов 53BP1, признанного маркера DSB, в течение 6 часов с помощью иммунофлуоресцентной микроскопии в фиксированных клетках.Окрашивание циклином А использовали в качестве маркера для клеток, положительных по S- / G2-фазе. Образование фокусов 53BP1 индуцировалось как в позитивных, так и в негативных клетках по циклину А после обработки FA или CPT, что дополнительно подтверждает генотоксичность, индуцированную DPC (F и S6G – S6I). Однако среднее количество фокусов 53BP1 на клетку увеличивалось в 2-3 раза после обработки FA или CPT в клетках HeLa-SPRTN, положительных по циклину А, по сравнению с контрольными клетками HeLa (F и S6G). Напротив, количество фокусов 53BP1 в циклин A-отрицательных клетках было одинаковым как в Δ-SPRTN, так и в контрольных клетках (Фигуры S6H и S6I).Эти результаты предполагают, что SPRTN предотвращает DPC-индуцированные DSB во время синтеза ДНК.
Обсуждение
Мы раскрыли механизмы понимания активности протеазы SPRTN для репарации DPC и установили SPRTN как протеазу, связанную с репликацией ДНК (). Наша работа определяет недостающую протеазу, участвующую в репликации ДНК и процессинге сшивок топоизомеразы 1 и 2 (Ashour et al., 2015, Duxin et al., 2014, Gao et al., 2014, Interthal and Champoux, 2011). Биохимическая характеристика мутаций SPRTN у пациентов с RJALS показывает, что RJALS вызывается дефектом активности протеазы SPRTN, что делает его неспособным обрабатывать DPC во время репликации ДНК и, следовательно, приводит к стрессу репликации ДНК, одной из основных причин нестабильности генома и рака.
Модель восстановления DPC, связанного с репликацией ДНК
SPRTN является составной частью реплисомы и расщепляет DPC во время развития репликационной вилки. Протеаза SPRTN защищает пролиферативные клетки от цитотоксичности, вызванной DPC (слева). Дефицит SPRTN (мутации SPRTN у RJALS, SPRTN гаплонедостаточные мыши) вызывает остановку вилки репликации ДНК из-за патологического накопления DPC, что, в свою очередь, приводит к DSB и геномной нестабильности (справа).
Протеолиз SPRTN, связанный с репликацией ДНК
Наши результаты согласуются с недавними биохимическими данными по экстракту яиц Xenopus , показывающими, что протеолиз, связанный с репликацией ДНК, необходим для удаления DPC (Duxin et al., 2014), модель, предложенная лабораторией Санкара (Reardon et al., 2006). Однако фермент этого пути оставался неизвестным до сих пор, когда мы показали, что SPRTN является активной протеазой и составной частью реплисомы. Принимая во внимание, что DPC распространены повсеместно и что практически любой белок, присутствующий в непосредственной близости от ДНК, может быть сшит, протеолитическая активность SPRTN в репликации ДНК имеет важное значение. Динамика клеточного цикла экспрессии SPRTN подтверждает нашу гипотезу, при этом SPRTN отсутствует в G0 T24-клеток и появляется при входе в S-фазу.Это согласуется с опубликованными данными, показывающими, что уровень SPRTN подавляется в клетках в фазе G1 с помощью E3-ubiquitin ligase APC-комплекса и усиливается, когда клетки входят в S-фазу (Mosbech et al., 2012). Поэтому мы предполагаем, что это путь репарации ДНК для удаления DPC в пролиферативных клетках. Мы не можем исключить потенциальную роль SPRTN в непролиферативных клетках, но если она существует, эта функция не связана с репарацией DPC, связанной с репликацией ДНК.
Восстановление перекрестных связей ДНК-белок
Наша работа направлена на решение возникающего вопроса в области репарации ДНК: как DPC удаляются из хроматина? Несмотря на частое появление DPC, мы плохо понимаем процесс восстановления DPC (Ide et al., 2015). Считается, что репарация DPC частично зависит от двух канонических путей репарации ДНК, NER и HR (Barker et al., 2005, Nakano et al., 2007). Однако оба пути репарации ограничены тем фактом, что NER может действовать только на более мелкие поперечные сшивки, не превышающие 11 кДа, а HR полагается на образование DSB, которое приводит к рекомбиногенным событиям и связанной с ними геномной нестабильности. Как следствие, другие механизмы репарации должны быть вовлечены в процессинг DPC и поддержание стабильности генома.Действительно, накопление DPC не наблюдается ни при инактивации ключевых игроков NER и HR, ни при пути анемии Фанкони (рис. S2A), что позволяет предположить, что SPRTN-зависимый путь репарации DPC является основным специализированным путем репарации DPC в клетках человека. Ранняя эмбриональная летальность мышей с нокаутом SPRTN (Maskey et al., 2014) и идентификация SPRTN как одного из важнейших генов в геноме человека (Hart et al., 2015, Wang et al., 2015) еще раз подтверждают заключение, что SPRTN является критическим компонентом уникальной системы репарации ДНК, а именно пути репарации DPC.
Характеристика мутаций пациентов с RJALS
Мы продемонстрировали, что протеазная активность мутации пациента SPRTN Y117C сильно влияет на все тестируемые субстраты. Причина, по которой мутация Y117C влияет на ферментативную активность SPRTN, не ясна. Сравнение последовательностей показывает, что этот остаток не является строго консервативным среди гомологов SPRTN (фигура S7A), хотя он обычно является гидрофобным даже среди более широкого семейства цинцина. Непосредственная близость Y117 к каталитическому центру, расположенному всего на два остатка ниже второго потенциального Zn-связывающего гистидина (h215), и неконсервативный характер замены указывают на то, что вариант может быть неспособен образовывать активный сайт с правильная геометрия.Возможно, это результат стерических эффектов, включающих расположение конца HEXXH-содержащей спирали и последующей петли, содержащей третий потенциальный лиганд Zn 2+ .
Другая патогенная мутация, SPRTN-ΔC, протеолитически активна по отношению к себе (авторасщепление) и гистонам (H и D), но серьезно нарушена в процессинге Topo1 и Topo2α (G). Чувствительность истощенных SPRTN клеток к CPT не может быть полностью восстановлена с помощью SPRTN-ΔC, предполагая, что эта мутация пациента, хотя и протеолитически активна, не может должным образом обрабатывать определенные субстраты, такие как Topo1 и Topo2.Одна из причин может заключаться в том, что С-концевая часть важна для связывания определенных субстратов и участвует в специфичности субстрата SPRTN. Повышенные уровни DPC в клетках пациентов с RJALS и неспособность репликации ДНК в клетках RJALS справиться с индукцией неферментативных (FA) или ферментативных (CPT) DPC, демонстрируют, что DPC, такие как Topo1 и Topo2α, и наиболее вероятно многие другие являются основной причиной синдрома RJALS. Мы предполагаем, что RJALS — это заболевание человека, связанное с дефектным путем репарации DPC.
Сравнение SPRTN и Wss1
Биоинформатический анализ предполагает, что SPRTN и Wss1 имеют общего предка (Stingele et al., 2015). Хотя верно то, что оба фермента отдаленно родственны суперсемейству металлопротеиназы цинка, две последовательности можно выровнять только по относительно короткой области 95 аминокислотных (аа) остатков с 24% идентичностью последовательностей (сравнение последовательности S. cerevisiae человека и S. cerevisiae ферменты) (Рисунок S7B). Эта общая область включает консервативный мотив HEXXH, общий для более широкого набора ферментов с различными функциями, который обеспечивает платформу для связывания Zn 2+ через два гистидина, причем соседний остаток глутамата, как полагают, играет роль в катализе (Hooper, 1994).Помимо этого общего ядра, не удалось найти никаких других областей сходства последовательностей. Wss1 и SPRTN проявляют сходные ферментативные свойства, но их клеточная функция частично не связана. SPRTN взаимодействует с аппаратом репликации ДНК и связывает убиквитинированные субстраты посредством своих Ub-связывающих доменов, тогда как Wss1 связывает и обрабатывает SUMOylated субстраты посредством своих взаимодействующих с SUMO мотивов (Balakirev et al., 2015). Инактивация SPRTN вызывает массовое накопление общих DPC в пролиферативных клетках человека, включая Topo1, Topo2α и гистоны.Напротив, дрожжевые клетки, лишенные Wss1, не накапливают общие DPCs и не обнаруживают гиперчувствительности к CPT (Stingele et al., 2014).
№ 8 Бобры не спотыкаются с QB Коди Ваз
Через несколько мгновений после того, как Коди Ваз впервые выступил в качестве стартового квотербека в штате Орегон, Интернет загудел.
« VAZzle-Dazzle », « VAZ-tacular » и « VAZ-matazz » были среди прозвищ, о которых шла речь. В Твиттере была популярна песня Cody Vaz.
Ваз, сделав свой первый старт со школы, бросил на 332 ярда и трижды приземлился в No.8 Штат Орегон — 42-24 победы над BYU в субботу. Он выполнил 20 из 32 передач.
Юниор ростом 6 футов 1 см, заменивший травмированного квотербека Шона Мэнниона, был назван игроком недели Pac-12 в понедельник.
: « Не думаю, что кто-то в нашей раздевалке был особенно удивлен хорошей игрой Коди, — сказал тренер Майк Райли. « Думаю, они давно верят в него как в товарища по команде ».
В дополнение к классному завершению на 59 ярдов Брандину Куксу и еще одному стабильному 29-ярдовому игроку в тайт-энд Коннору Хамлетту, Ваз заблокировал защитника BYU, который проложил путь Маркусу Уитону, чтобы забить на 12-ярдовой четвертой. — реверс четверти, увеличивший преимущество штата Орегон до 11 очков.
Ваз был профессионалом на протяжении всей игры и даже подбадривал команду перед началом четвертой четверти.
« Я просто сказал: « Четвертый квартал — наш квартал » … Я просто хотел немного поднять настроение », — сказал Ваз.
Теперь говорят о футболках от бренда Beavers BelieVAZ.
Перед началом субботы Ваз сыграл за «Бобров» всего пять игр, выполнив шесть из 17 передач на 48 ярдов. Он не играл в живом матче с 2010 года.
Победа над BYU переместила «Бобров» к открытию сезона 5: 0, их лучший старт с 1939 года. Выступление Ваза стало последним сюрпризом в неожиданном сезоне для штата Орегон, который в прошлом году проиграл всего 3-9.
Травма Мэнниона также стала неожиданностью даже для Райли. Второкурсник ростом 6 футов 5 дюймов был травмирован при передаче команды «Бобров», выигравшей 19-6 раз над штатом Вашингтон неделей ранее, но он так и не покинул игру и закончил с передачей на 270 ярдов и приземлением.
Два дня спустя Бобры узнали, что Манниону понадобится операция по восстановлению мениска в левом колене. На прошлой неделе ему сделали операцию, и он выбыл на неопределенный срок, хотя может вернуться до конца регулярного чемпионата.
Маннион в среднем показывал 339,5 ярдов, проходя игру, затем занимал второе место в Pac-12 и шестое место в стране. В этом сезоне он совершил бросок на 1358 ярдов с семью тачдаунами и четырьмя перехватами. Он занимает шестое место в списке карьеры штата Орегон с 4686 ярдами.
В прошлом сезоне, будучи первокурсником в красной рубашке, Мэннион обошел младшего стартера Райана Каца, который начал сезон 2010 года в составе «Бобров».С тех пор Кац перебрался в штат Сан-Диего, сделав Ваза дублером в этом сезоне.
Ваз вырос в Лоди, штат Калифорния, и играл в средней школе Святой Марии, где ему было 24-5 в двух сезонах в качестве стартера. Он был игроком года по версии Stockton Record в старшем сезоне.
Но он играл второстепенную роль до прошлой субботы. Бобры, которые показывают счет 3: 0 в игре Pac-12, принимают Юту в субботу вечером на стадионе Резер.
: « Это просто отличный признак того, что парень будет готов долгое время, и это часть идентичности нашей футбольной команды », — сказала Райли.« Ребята готовятся к игре, и когда их вызывают, они входят и делают свою работу ».
ДНК-протеиновые перекрестные протеазы в стабильности генома
Wss1 и SPRTN: обнаружены первые представители класса репаративных ферментов
Репарация протеолиза DPC была обнаружена в дрожжах с помощью металлопротеиназы Wss1 3 . Сопутствующее исследование экстракта яиц Xenopus намекало на аналогичный путь у многоклеточных животных 33 . Выделенным ферментом у многоклеточных животных позже оказался SPRTN 4,5,6 .Однако филогенетический анализ показал, что Wss1 и SPRTN являются не ортологами, а функциональными гомологами 1,11,34 . Сходство между их последовательностями ограничено доменами протеаз — WLM и SprT — и вокруг активного центра, типичного для металлопротеаз (HExxH), и они демонстрируют 24% идентичности 5 (рис. 2).
Wss1 и SPRTN придают устойчивость к FA, показывая общую роль в ремонте DPC. 3,4,5,6 . Это также подтверждается исследованиями расщепления in vitro, которые демонстрируют, что Wss1 и SPRTN могут обрабатывать ДНК-связывающие белки различного размера и структуры, примером которых является меньший гистон h4 и более крупный Topo-2 3,4,5,6 .Хотя Wss1 способен обрабатывать очищенный Topo-1, только делеция WSS1 не сенсибилизирует дрожжевые клетки к CPT, что резко контрастирует с эффектами истощения SPRTN в клетках млекопитающих 3,5 . Это связано с существованием дрожжевой протеазы с аналогичной функцией и будет обсуждаться ниже. Хорошее объяснение этой неразборчивости было получено из структурных исследований дрожжевого домена WLM 35 . Поскольку домен протеазы не имеет кармана для связывания субстрата, он может вмещать широкий спектр структур.В результате протеолиза DPC остаточный пептид еще неустановленного размера прикреплен к ДНК. Хотя этот остаток менее проблематичен для репликации и транскрипции ДНК, его необходимо восстанавливать с помощью других активностей (например, нуклеаз, тирозил-ДНК-фосфодиэстераз) в координации с протеолизом или после него. Как это достигается, не совсем понятно.
Активные протеазы DPC потенциально опасны, и клетки применяют стратегии для ограничения их активности 7 . Во-первых, Wss1 и SPRTN связываются и активируются одноцепочечной (ss) и двухцепочечной (ds) ДНК 3,4,5,6,36,37,38 ; эта функция защищает растворимые в ядрах белки от нежелательного протеолиза.Структура домена SprT из человеческого SPRTN предполагает, что зависимость от ДНК зависит от экранирования активного сайта в отсутствие ДНК; Связывание ДНК открывает узкую бороздку с каталитическими остатками для пептидного расщепления 37 . Во-вторых, Wss1 и SPRTN способны к саморасщеплению trans в присутствии ДНК; это свойство является регуляторным механизмом для отключения протеазной активности при нахождении на хроматине 4 . В-третьих, активность протеаз DPC дополнительно обостряется посттрансляционными модификациями (фосфорилирование, убиквитилирование, SUMOylation, ацетилирование) протеаз DPC и / или их субстратов, а также взаимодействием с белками-партнерами, например, скользящим зажимом PCNA (пролиферирующим клеточным ядром). антиген), АТФаза p97 или связывающий белок Topo-1 TEX264.Последний пункт будет раскрыт в отдельный абзац.
Новые протеазы DPC в стабильности генома
В последнее время в качестве потенциальных ферментов репарации DPC появились протеазы, отличные от SPRTN. Это ACRC / GCNA, FAM111A и B, DDI1 и DDI2 у человека и их соответствующие ортологи. Среди ферментов человека SPRTN является единственным важным геном в различных линиях раковых клеток (Таблица 1; www.depmap.org).
Таблица 1 Важность генов, кодирующих протеазы DPC.Эти появляющиеся протеазы DPC были связаны с процессингом DPC и прочно связанными белками (рис. 2 и 3). Помимо протеазного домена, где картируются консервативные каталитические остатки (Fig. 2), они обладают замечательным сходством в общей организации домена, которая лежит в основе потенциально сходных паттернов регуляции. Тем не менее, некоторые протеазы могут быть более специфичными для определенной фазы клеточного цикла, стадии развития или класса субстратов.
Рис. 3: Перекрывающиеся и неперекрывающиеся функции протеаз DPC.a Wss1 и Ddi1 оба необходимы для репарации неферментативных DPC и Topo-1cc во время репликации. b FAM111A и SPRTN оба участвовали в разрешении Topo-1cc на основании устойчивости к CPT. c Чувствительность к ингибиторам PARP-1 и анализы расчесывания ДНК позволяют предположить, что FAM111A, но не SPRTN, участвует в разрешении захваченного PARP-1. d GCNA человека разрешает перекрестные связи DNMT1 в сайтах включения 5-azadC (красная стрелка) за вилкой репликации. e GCNA разрешает Topo-2cc у мух, червей и рыбок данио.
ядерный антиген зародышевой клетки; также известный как белок, содержащий кислотные повторы (ACRC)]
Ядерный антиген зародышевой клетки (GCNA) содержит домен металлопротеазы SprT, консервативный у эукарий 11,39 . У многоклеточных животных он экспрессируется в зародышевых клетках, где недавно было показано, что он нацелен на Topo-2ccs 40,41 . GCNA, эктопически экспрессируемая в клетках культуры млекопитающих, также участвует в разрешении индуцированных 5-azadC сшивок DNMT1 42 (рис.3). GCNA не важен в клеточных линиях млекопитающих (Таблица 1), но его нокаут (KO) увеличивает шансы эмбриональной летальности у мух, червей и рыбок данио 40 .
Белки, индуцируемые повреждением ДНК 1 (DDI1) и DDI2
Белки DDI1 и DDI2 представляют собой аспарагиновые протеазы, которые взаимодействуют с убиквитином и протеасомой через убиквитин-подобный домен (UBL) 43,44 (рис. 2). Они способствуют перезапуску протеасомно-зависимой репликационной вилки после репликативного стресса посредством деградации фактора терминации репликации 2 (RTF2) 44 .Прямое участие в репарации DPC еще не изучено, однако недавно было показано, что S.cerevisiae гомолог Ddi1 помогает Wss1 в разрешении CPT-индуцированных и FA-индуцированных DPCs 45,46 .
Семейство со сходством последовательностей 111 член A (FAM111A)
FAM111A и его гомолог FAM111B являются сериновыми протеазами. О FAM111B известно немного, за исключением его связи с этиологией формы пойкилодермии с легочным фиброзом (ПОИКТМП) 47 .FAM111A был ранее описан как взаимодействующий с PCNA и его роль в ограничении репликации вируса в клетках-хозяевах 48,49,50 . Только недавно он был вовлечен в репарацию Topo-1cc и захватил PARP-1 51 (Figs. 3 and 4).
Рис. 4: Протеолиз не-DPC субстратов во время репликации ДНК.a Wss1 расщепляет избыточные гистоны, связывающиеся с оцДНК после остановки вилки. оцДНК образуется после HU. b PARP-1 рекрутируется в ДНК для восстановления различных типов повреждений, включая аддукты оснований, генерируемые алкилирующими агентами.В присутствии ингибиторов PARP блокируется само-PARylation и диссоциация хроматина. Захваченный PARP-1 представляет собой барьер для репликации. FAM111A придает устойчивость к ингибиторам PARP, но вопрос о том, протеолитически ли он действует на PARP-1, требует формальной проверки. c Во время репликации ДНК SPRTN расщепляет C-конец Chk1 и высвобождает активный домен киназы (K) из хроматина.
Доказательства того, что GCNA, DDI и FAM111A расщепляют субстраты DPC, в настоящее время отсутствуют. Однако они обладают каталитической активностью.Саморасщепление FAM111A было показано in vitro и в клетках 51,52 ; Sc Ddi1 и Hs DDI2 обрабатывают субстраты, модифицированные длинными убиквитиновыми цепями in vitro 53,54 . Более того, исследования комплементации показывают, что мутации в предполагаемых каталитических остатках GCNA 40 , Sc Ddi1 45 и FAM111A 51,52 генерируют нефункциональные белки. Для Sc Ddi1 активность in vitro была протестирована в присутствии дцДНК, активатора Wss1 и SPRTN, но безуспешно. 45 .Хотя ДНК-зависимая активность была установлена как регуляторный механизм для Wss1 и SPRTN, разные протеазы могут отвечать на разные способы регуляции.
Общей чертой протеаз DPC является связывание с ДНК, что является подтверждением их функции, связанной с хроматином. Минимальные ДНК-связывающие домены (DBD, рис. 2) были картированы путем тестирования усеченных версий в обоих анализах связывания ДНК (например, EMSA) — как для Wss1, SPRTN и FAM111A 3,4,5,37,51,55 — или исследования комплементации в клетках — как для HDD Ddi1 (спиральный домен Ddi1) 45,46 .Подобно SPRTN и Wss1, FAM111A может связывать оцДНК, и целостность этого домена необходима для саморасщепления in vitro, а также для его функции в клетках 51 . Возможная интерпретация оцДНК-зависимого протеолиза будет разработана позже.
Перекрывающиеся функции протеаз DPC
Существование различных протеаз DPC указывает на то, что клетки инвестировали в несколько ферментов для противодействия DPC-зависимой токсичности (рис. 3). Это не удивительно, учитывая гетерогенную природу сшитых белков.Хотя SPRTN не обладает строгой специфичностью последовательности, он предпочтительно расщепляет ДНК-связывающие белки в плохо структурированных областях, богатых остатками лизина, аргинина и серина 5 . Существование альтернативных протеаз могло бы гарантировать, что сшитые белки, лишенные этих свойств, эффективно процессируются для предотвращения геномной нестабильности. Здесь мы подчеркиваем функциональное перекрытие между Wss1, SPRTN и другими протеазами.
У многоклеточных животных GCNA преимущественно экспрессируется в половых клетках и ранних эмбрионах 39 .Поэтому большинство исследований проводилось на животных моделях, а не на клетках человека. У Drosophila и мутация C.elegans , GCNA подвергает зародышевые клетки и эмбрионы стрессу репликации — образованию очагов RPA / γh3Ax и чувствительности к гидроксимочевине (HU) — и геномной нестабильности, например, дефектам сегрегации хромосом и микроядер, которые общий предел репродуктивного успеха 40,41 . C.elegans дефекты фертильности усугубляются сопутствующими мутациями в гомологе SPRTN dvc-1 40,41 .Эмбрионы Drosophila , мутировавшие как в Gcna , так и в mh (материнский гаплоид, mh, является гомологом Drosophila SPRTN), не завершают эмбриогенез 40 . Устанавливая роль в репарации DPC вместе с DVC-1 / mh, делеция GCNA увеличивает общее количество DPC в половых клетках и ранних эмбрионах мух, червей и рыбок данио 40 , причем Topo-2cc является одним из самых распространенных 40,41 . Эмбрионы мутантных червей Dvc-1 и gcna-1 одинаково чувствительны к формальдегиду 42 .В целом это указывает на перекрытие между GCNA и DVC-1 на уровне организма. Зародышевые клетки и эмбрионы особенно уязвимы для геномной нестабильности, возникающей в результате накопления DPC, поскольку ошибки могут передаваться по наследству. Кроме того, изменения в экспрессии генов и деметилирование гистонов во время эмбиогенеза 56 могут особенно подвергать зародышевые клетки высвобождению FA 17 и образованию DPCs, что объясняет необходимость наличия множественных протеаз DPC.
S.cerevisiae Ddi1 и человеческий FAM111A необходимы для устойчивости к Topo-1ccs, общей мишени дрожжевого Wss1 и человеческого SPRTN.В отличие от одной мутации wss1 , делеция WSS1 и DDI1 сенсибилизирует дрожжевые клетки к CPT и идентифицирует Ddi1 как неуловимую, избыточную протеазу для репарации Topo-1cc 3,45 . Генетические данные дополнительно указывают на то, что Ddi1 придает устойчивость к DPC-индуцирующему агенту FA вместе с Wss1 45,46 .
SPRTN и FAM111A также имеют перекрывающиеся функции. Оба белка были обнаружены в зарождающейся ДНК 5,50,57 , и оба предотвращают остановку репликационной вилки в присутствии сшивающих агентов, в частности, FA для SPRTN 5,58 и CPT как для FAM111A, так и для SPRTN 51 .Истощение FAM111A, по-видимому, не снижает скорость вилки в неизменных условиях, в отличие от мутации SPRTN 5,51,59,60,61 . Таким образом, FAM111A может вступить в игру, когда перегрузка DPC превышает пропускную способность SPRTN, которая выражается на низких уровнях. В настоящее время такое взаимодействие носит чисто умозрительный характер. Интересно, что FAM111A KO, но не SPRTN гипоморфные клетки чувствительны к ингибиторам PARP-1, которые, как было показано, улавливают PARP в ДНК, предполагая, что некоторые протеазы DPC могут иметь предпочтение для определенных субстратов 51 .
Регулирование протеаз DPC с помощью посттрансляционных модификаций
Посттрансляционные модификации (PTM) обладают большим регуляторным потенциалом, и большинство обсуждаемых здесь протеаз могут связывать убиквитин через убиквитин-ассоциированный домен (UBA) или убиквитин-связывающий цинковый палец (UBZ) или SUMO (Small ubiquitin-like modifier) через SUMO-взаимодействующий мотив (SIM) (рис. 2). Обработка клеток агентами, индуцирующими DPC, такими как FA и 5-azadC, индуцирует сигнальные каскады, которые завершаются модификацией сшитых белков убиквитином и SUMO 42,62,63 .Мы можем предсказать, что вербовка или постоянство на месте повреждения модулируется PTM. GCNA, например, локализуется в фокусах DNMT1, которые образуются после обработки 5-azadC; это перемещение зависит от SUMOylation и SIMs 42 GCNA (рис. 2). SPRTN образует ядерные фокусы после воздействия FA и не может этого сделать при фармакологическом ингибировании пути убиквитилирования 42,62 . Еще предстоит продемонстрировать, зависит ли это перемещение от УБЗ. Это первоначальное свидетельство, подтвержденное преобладанием SUMO-взаимодействующих и ubiquitin-взаимодействующих доменов, доказывает, что протеазы DPC обладают потенциалом для регулирования посредством взаимодействия с посттрансляционно модифицированными белками.
Протеазы DPC могут быть изменены в нормативных целях. SPRTN существует в моноубиквитилированной форме, но воздействие FA ведет к его деубиквитилированию — два разных исследования идентифицировали деубиквитилирующие ферменты VCPIP и USP11 — и ацетилированию, чтобы позволить рекрутирование на хроматин 4,64,65 .
Wss1 и SPRTN взаимодействуют с АТФазой Cdc48 / p97, также известной как валозин-содержащий белок (VCP) у млекопитающих, через SHP (супрессор PP1 с высокой копией) и мотив, взаимодействующий с VCP (VIM) 3,36,66 , 67,68 (рис.2). Cdc48 / p97 представляет собой убиквитин-зависимый и SUMO-зависимый шаперон, действующий со специфическими кофакторами для разворачивания субстратов для протеасомной деградации или разборки из различных макромолекул 69,70 . Разворачивающаяся активность p97 непосредственно способствует репарации Topo-1cc, в которую p97 рекрутируется через свой новый кофактор TEX264 (Testis Express 264) перед SPRTN-опосредованным протеолизом 68 . Остается установить, являются ли и как развороты конститутивным требованием репарации протеолиза DPC.
DPC протеазы и репликация ДНК
DPC могут задерживать репликативный комплекс ДНК-геликазы CMG (Cdc45-Mcm2-7-Gins) и / или ДНК-полимеразу во время репликации ДНК, в зависимости от их размера и местоположения (ведущая или отстающая цепь) 33 , 71 (рис.1). Активно реплицирующиеся клетки более восприимчивы к FA и CPT, чем нереплицирующиеся клетки 5,72,73 . Если их не исправить, эти препятствия репликации могут вызвать длительное срывание вилки, которое приводит к коллапсу вилки, образованию двухцепочечных разрывов (DSB) и геномной нестабильности 74 .
В дрожжах, Wss1 был предложен для обеспечения завершения репликации ДНК после воздействия FA 3 , а Ddi1 рекрутируется в сайт повреждения для удаления модельного DPC в синхронизированных S-фазе дрожжевых клеток 45 . Однако репарация DPCs зависимым от репликации ДНК способом была более прямо показана для SPRTN как в человеческих клетках 5 , так и в экстракте яиц Xenopus 75,76 .
В соответствии с репарацией в S-фазе уровни SPRTN выше в фазе S / G2 — из-за APC (комплекса, стимулирующего анафазу) -Cdh2-зависимой деградации в фазе G1 66 — когда он локализуется непосредственно на вилке репликации 5, 57 .SPRTN взаимодействует с PCNA через PIP (PCNA-взаимодействующий белок) -box (рис. 2), который необходим для рекрутирования SPRTN в репликационную вилку. Вариант усечения, лишенный C-конца (и, следовательно, PIP-бокса), все еще локализуется в зарождающейся ДНК в iPOND (выделение белков на зарождающейся ДНК) в экспериментах 57 и восстанавливает длину волокна ДНК 60 . Таким образом, неясно, как SPRTN взаимодействует с аппаратом репликации для восстановления DPC.
In vitro процессинг субстрата с помощью SPRTN наиболее эффективно стимулируется оцДНК — с потенциалом образования шпилек — или структурами дцДНК с зазубринами или промежутками, близкими к сшитому белку 4,37,38 .Это согласуется с результатами, полученными в экстрактах яиц Xenopus с использованием плазмиды DPC, где SPRTN расщепляет модельный DPC без продолжающейся репликации, когда есть разрыв в комплементарной нити ДНК 75 . Во время репликации ДНК в клетках разобщение между геликазой и застопорившейся ДНК-полимеразой раскрывает оцДНК и генерирует «гибрид» дцДНК / оцДНК, который совместим с моделью in vitro. Этот специфический контекст ДНК предположительно защищает несшитые ассоциированные с хроматином белки от активности SPRTN 38 .
GCNA также активен в S-фазе. Его роль в синтезе ДНК подтверждается стрессом репликации (образование фокусов RPA / γh3Ax) в митотически активных половых клетках мутантных мух и червей GCNA 40 , а также тем фактом, что компоненты Mcm2-7 геликазы CMG сложная фигура среди DPC в GCNA мутантных эмбрионах мух 40 . Другое исследование связывает GCNA с разрешением перекрестных связей DNMT1, хотя это было показано с эктопически экспрессируемой GCNA в соматических клетках человека 42 .Сшивки DNMT1 образуются позади репликационной вилки, когда DNMT1 рекрутируется на вновь синтезированную ДНК для восстановления паттерна метилирования ДНК, где он может сшиваться в присутствии 5-azadC. Остается определить, нуждается ли эффективная репарация поперечных связей DNMT1 в каталитической активности GCNA.
Уровни FAM111A увеличиваются в поздней фазе S и остаются высокими во время G2 / M 48 . FAM111A взаимодействует с PCNA через PIP-бокс (рис. 2) 50,52 . Неясно, в какой степени истощение FAM111A нарушает репликацию ДНК.Исследования внедрения EdU дали противоречивые результаты 50,52,61 . Анализы расчесывания ДНК в отсутствие экзогенного повреждения либо показали отсутствие уменьшения длины растущей ДНК в FAM111A-истощенных клетках, либо небольшое увеличение длины тракта, чтобы компенсировать уменьшение исходной активности 51,61 . Вместо этого FAM111A KO снижает скорость репликации при лечении ингибиторами CPT и PARP и увеличивает клеточную чувствительность к этим ядам 51 .Соответственно, фокусы Topo-1cc накапливаются в KO-клетках; интактный PIP-бокс и интактный домен протеазы необходимы для спасения этих фенотипов 51 . Хотя протеолиз Topo-1 in vitro до сих пор не показан, FAM111A может потребоваться для устранения барьеров репликации. В этом отношении степень совпадения с SPRTN еще предстоит определить.
Поразительно, что сверхэкспрессия FAM111A вызывает включение EdU и дефекты клеточного цикла и, следовательно, увеличивает скорость повреждения ДНК и апоптоза; это, вероятно, связано с неспецифическим расщеплением белков репликационной вилки, например.g., PCNA и RFC (фактор репликации C) 50,52,61,77 . Однако сверхэкспрессия мутированного варианта PIP-box повторяет эти фенотипы до некоторой степени, утверждая, что связывание с PCNA может не быть причиной проблем репликации 50,52,61 . Эти дефекты репликации усугубляются сверхэкспрессией вариантов FAM111A, несущих болезнетворные мутации (синдром Кенни-Каффи тип 2, см. Ниже и рис. 2) 52,61,77 . Сверхэкспрессия мутантных вариантов FAM111B, вызывающих ПОИКТМП (рис.2), в значительной степени имитирует фенотип сверхэкспрессии FAM111A 52 . В обоих случаях сопутствующие мутации в доменах протеаз устраняют эти дефекты, показывая, что наблюдаемые фенотипы являются прямой причиной FAM111A / B-зависимого протеолиза 52 . Эти данные свидетельствуют о том, что нарушение регуляции ферментативной активности FAM111A / B пагубно для клеток. Таким образом, жесткая регуляция уровня и активности этих протеаз имеет решающее значение для успешного завершения репликации ДНК.
Нисходящий путь и синтез ДНК трансформации
Синтез ДНК трансформации (TLS) — это механизм устойчивости к повреждениям, при котором обычная ДНК-полимераза заменяется подверженной ошибкам полимеразой TLS, которая обходит поражение.Этот переключатель зависит от PCNA и его убиквитилирования с помощью E3 ubiquitin ligase Rad18 78 . SPRTN был связан с регулированием TLS после УФ-повреждения до того, как была установлена его роль в восстановлении DPC 66,67,79,80,81,82 . SPRTN взаимодействует как с PCNA, так и с убиквитином, но не совсем ясно, как SPRTN регулирует TLS. Некоторые исследования предполагают, что это положительный регулятор TLS 79,81,82 , в то время как другие предполагают, что SPRTN предотвращает УФ-индуцированный, TLS-зависимый мутагенез 66,67,80 .
Хотя регулирование TLS с помощью SPRTN изначально было связано с репарацией УФ-повреждений, вероятно, что обход остаточного пептида после объемного протеолиза DPC также требует TLS (Fig. 1). Некоторые доказательства подтверждают это: (i) УФ-свет может сшивать белки с ДНК 83,84,85 ; (ii) анализ эпистаза показывает, что Rad18 и SPRTN работают вместе 58 ; (iii) в экстрактах яиц Xenopus TLS-полимеразы необходимы для завершения репликации плазмиды, несущей модель DPC, после расщепления SPRTN 75 ; (iv) в дрожжах делеция WSS1 снижает частоту мутаций после FA 3 .Следовательно, TLS может действовать сразу после протеолиза DPC, чтобы избежать остановки вилки, поскольку мутации по-прежнему более желательны, чем коллапс репликационной вилки.
Есть один случай, когда накопление мутаций может быть полезным. Это гипермутация локусов иммуноглобулина. Было показано, что SPRTN способствует мутациям (ДНК-полимераза eta и zeta-зависимые) в abasic сайтах и опосредованной переключением матрицы конверсии гена во время диверсификации гена иммуноглобулина в куриных B-клетках 86 .Примечательно, что абазические сайты являются обычным источником образования DPC, а фенотип гипермутации согласуется с TLS, действующим ниже протеолиза DPC. В соответствии с этим, более низкие частоты мутаций в локусе иммуноглобулина наблюдаются в SPRTN-истощенных клетках 86 . Это предполагает, что SPRTN играет роль в создании разнообразия репертуара иммуноглобулинов и в пути устойчивости к повреждению ДНК, когда вилки репликации ДНК останавливаются.
Восстановление DPC вне фазы S
Несмотря на многочисленные доказательства, связывающие SPRTN с протеолизом DPC, связанным с репликацией, не исключена независимая от репликации функция SPRTN 4,5 . SPRTN мутации или недостаточность проявляются в гепатоцеллюлярную карциному 57,60 . Печень может быть больше подвержена воздействию DPC, чем другие органы, потому что вдыхаемые и проглоченные соединения могут катаболизироваться в формальдегид. Однако подавляющее большинство гепатоцитов находятся в состоянии покоя ( 87 ), поэтому вполне вероятно, что SPRTN работает вне S-фазы, и что неправильное функционирование может привести к раку. Также возможно, что повреждение печени, наблюдаемое у SPRTN -мутировавших пациентов или гипоморфных мышей SPRTN , инициируется во время S-фазы эмбриогенеза, но этот дефект проявляется позже.
Личинки червей, задержанные голодом, где репликация не происходит (клетки задерживаются в G1 / S), чувствительны к формальдегиду 4 , что указывает на то, что затронуты процессы, отличные от синтеза ДНК. Другой пример активности SPRTN вне S фазы происходит от Drosophila . Экспрессия мутировавшего mh (гомолог SPRTN) из материнского генома в зиготе приводит к потере отцовской ДНК во время первого митотического деления и приводит к летальности гаплоидных эмбрионов — отсюда и название mh, «материнский гаплоид» 88 , 89 .Эта потеря вызвана отсутствием конденсации отцовской ДНК во время митоза, и она по своей природе не связана с репликацией ДНК и S-фазой 88 . Ремоделирование отцовской ДНК все еще зависит от каталитической активности mh, но механизм неясен 88,89 .
GCNA также работает вне фазы S. Его экспрессия достигает пика в митозе, где он локализуется на хромосомах 41 . Topo-2cc являются известными целями GCNA 40,41 . Topo-2ccs в изобилии в митозе, потому что активность Topo-2 необходима для разделения сестринских хроматид.Поддерживая роль GCNA в репарации Topo-2cc, GCNA и Topo-2 физически взаимодействуют и колокализуются, а мутантные черви чувствительны к этопозиду, но не к камптотецину 41 .
В целом эти данные подтверждают, что активность протеазы DPC важна для поддержания целостности генома во время репликации ДНК, а также вне S-фазы.
DPC протеазы и транскрипция
DPC также являются потенциальными препятствиями для транскрипции 20 . Хотя задержка транскрипции и мутагенез могут угрожать стабильности генома 90 , влияние DPC на прогрессирование РНК-полимераз в значительной степени игнорируется.
Появились некоторые доказательства связи протеаз DPC и транскрипции. Rpb1, самая большая и каталитическая субъединица РНК-полимеразы II, разрушается посредством Ddi1 и Wss1 после воздействия HU или УФ-света 45 . Обе протеазы взаимодействуют с Rpb1. Однако это доказательство не дает достаточных доказательств того, что Ddi1 и Wss1 нацелены на Rpb1 как сшитый белок. Его деградация может быть следствием остановки транскрипции из-за препятствий перед РНК-полимеразой II. Фактически, при этих обстоятельствах было описано, что деградация Rpb1 зависит от убиквитин-протеасомной системы, АТФазы Cdc48 / p97 и SUMO 91,92 .В любом случае застопорившийся, несшитый Rpb1 будет в равной степени «подходящим» для деградации протеазами DPC, поскольку существуют другие «не-DPC» субстраты, которые будут обсуждаться позже в этом обзоре.
Связь между транскрипцией и FAM111A в клетках человека также существует. Сверхэкспрессия FAM111A снижает уровни Rpb1 в хроматине и, следовательно, включение ЕС 52 . FAM111A также взаимодействует с Rpb1 при сверхэкспрессии 52 . Однако неясно, связаны ли эти фенотипы с прямым протеолизом Rpb1.
DPCs и протеасома
Наиболее изученным протеолитическим механизмом в клетке является протеасома 26S (далее протеасома), которая расщепляет белки, которые были ранее модифицированы убиквитином и не структурированы развёртыванием 93,94 . Неудивительно, что протеасомная активность была протестирована в отношении DPC 26 . Участие протеасомы подразумевает, что DPC д. Быть модифицирован убиквитином. Ранние источники доказательств показали, что ингибирование протеасом задерживает деградацию Topo-1/2 после воздействия Topo-1 и -2 ядов, предполагая, что протеасома необходима для репарации Topo-cc 95,96,97 .Однако эти начальные эксперименты не подтвердили образование убиквитилированных Topo-ccs. Убиквитилирование топоизомеразы было показано в экстрактах цельных клеток — скорее, чем на хроматине или Topo-ccs — и не было увеличения состояния убиквитилирования топоизомеразы после протеасомного ингибирования 95,97 . Более того, в этих исследованиях использовались очень высокие дозы СРТ (диапазон мкМ) 96,97 , которые сшивают 90% Topo-1 98 и могут вызвать перегрузку Topo-1cc, превышающую репарационную способность другого, репликационного — зависимые, протеазы.
Более поздние исследования прямо показали, что как ферментативные, так и неферментативные DPC модифицируются убиквитином 14,42,62,63,75 . Однако, ведет ли эта модификация к протеасомной деградации, кажется спорным, поскольку убиквитилирование скорее может иметь сигнальную роль 62 .
Сшитые белки могут быть одновременно модифицированы убиквитином и SUMO (SUMO-1 или SUMO-2/3) 42,62,63,75 . Модификация посредством SUMO-2/3 перед убиквитилированием указывает на участие SUMO-нацеленных ubiquitin ligases (STUbLs), которые убиквитилируют модифицированные SUMO субстраты для протеасомной деградации 42,63 .Однако были описаны сценарии, в которых эти две модификации независимы, хотя функция DPC SUMOylation в этих случаях остается неясной 62,75 .
S.cerevisiae Ddi1 — адаптер протеасомы 99 (рис. 2). UBL Ddi1 связывает протеасомную субъединицу Rpn1 100,101 и, в отличие от обычных доменов UBL, он также связывает убиквитин вместе с UBA 43,102 . Однако нет доказательств того, что Ddi1 участвует в репарации DPC с помощью протеасомы.Фактически, сверхэкспрессия мутантных версий, лишенных доменов UBL и UBA, дополняет делецию DDI1 в экспериментах по чувствительности FA, тогда как мутации предполагаемого каталитического домена нет 45 . Другой сценарий весьма вероятен для человеческих гомологов DDI1 и DDI2. DDI1 / 2 связывают протеасомы через свои UBL 43,44 (рис. 2). DDI1 / 2 рекрутирует протеасомы на застопорившихся вилках репликации для удаления RTF2, чья персистенция предотвращает перезапуск вилки после HU и вызывает нестабильность хромосом 44 .
Что касается протеасомозависимой репарации DPC во время репликации, эксперименты с экстрактами яиц Xenopus предоставили наиболее убедительные доказательства 75,76 . Напротив, в клетках млекопитающих убиквитилирование Topo-ccs посредством STUbL RNF4 перед протеасомной деградацией не зависит от репликации 63 . В недавнем отчете утверждается, что фермент HMCES перекрестно связывается с абазическими сайтами перед вилкой репликации. Таким образом, HMCES защищает базовые сайты от репликации TLS-полимеразами и предотвращает мутагенез 14 .Сшивки HMCES убиквитилированы и процессируются протеасомой, но роль других протеаз не была протестирована 14 . Хотя физиологическое сшивание должно происходить во время синтеза ДНК, чтобы предотвратить переключение на полимеразы TLS, не было установлено, что репарация HMCES-DPC протеасомой происходит во время репликации. Пострепликативная репарация вероятна, поскольку (i) HCMES-DPC как таковой представляет собой препятствие для прогрессирования ДНК-полимеразы и (ii) протеолиз протеасомой, вероятно, оставит пептид, который может останавливать ДНК-полимеразу.В любом случае должен существовать механизм толерантности, отличный от TLS, чтобы обойти DPC или остаточный пептид (например, переключение матрицы). Следовательно, пострепликативный протеасомозависимый протеолиз в этом случае остается формальной возможностью.
В заключение, связанный с репликацией протеолиз с помощью большого комплекса, такого как протеасома, остается вопросом будущих исследований на клетках млекопитающих. Например, будет информативным определить, появляются ли субъединицы протеасомы в формирующемся хроматине после обработки агентами, индуцирующими DPC (например,g., iPOND), поскольку оценка белков, обогащенных на остановившихся вилках, была полезна для других видов репликационного стресса 103 .
Протеазы DPC при обработке несшитых прочно связанных субстратов
Масс-спектрометрия была проведена на DPC, выделенных из клеток, лишенных SPRTN 5 и GCNA 40 , чтобы идентифицировать наиболее распространенные сшитые белки. Эти скрининги доказали, что топоизомеразы, гистоны и субъединицы Mcm геликазного комплекса CMG являются основными DPC в SPRTN-истощенных клетках и GCNA KO мух 5,40 .Ожидается, что в таких скринингах появятся белки, связывающие нуклеиновые кислоты, 5 , поскольку белки, действующие вблизи ДНК, скорее всего, сшиты. Однако эксперименты по расщеплению in vitro в основном проводятся на субстратах, которые имеют склонность к связыванию ДНК, но не сшиты с ДНК 3,4,5,6,37 . Следовательно, для расщепления необходима ассоциация ДНК, а не сшивание как таковое. Недавние исследования доказали, что это верно и для клеток. Три исследования ниже показывают, что протеазы нековалентно обрабатывают ДНК-ассоциированные белки для защиты клеток от ошибок репликации ДНК.
Гистоны: Недавнее исследование постулирует, что Wss1 деградирует несобранные, но нековалентно связанные гистоны во время стресса репликации 104 . Эта активность Wss1 будет защищать клетки от неспецифического связывания избыточных гистонов с оцДНК, накапливающейся после воздействия HU, что может мешать метаболизму ДНК 104 (фиг. 4A). Чувствительность мутантных дрожжевых клеток wss1 к HU значительно усиливается сопутствующей делецией DDI1 , а каталитически неактивный Ddi1 не спасает выживание клеток 45,46 .Таким образом, протеаза Ddi1, как и Wss1, может быть необходима, чтобы справиться со стрессом репликации за пределами DPC. Что еще интереснее, исследования комплементации у дрожжей подтверждают, что hDDI1 / 2 сохраняют ту же функцию 46 .
PARP-1: Плотно связанные белки могут быть так же опасны, как DPC, для развития репликационной вилки 105 . Этот сценарий хорошо иллюстрируется захватом PARP-1. PARP-1 — это фермент, участвующий в репликации ДНК и многих путях репарации ДНК 106,107 .PARP-1 катализирует образование цепей поли-АДФ-рибозы (PAR) — реакцию, известную как PARylation, — которая задействует другие репарационные белки; Само-PARylation запускает электростатическую диссоциацию хроматина, позволяя протекать реакции репарации 106 . Фармакологическое ингибирование приводит к тому, что PARP становится прочно связанным — или захватывается — на хроматине из-за дефектного самопарилирования. Сохранение хроматина из-за ингибиторов PARP более проблематично, чем каталитическое ингибирование как таковое 108 .Фактически, захваченный PARP-1 может вызывать коллапс репликационной вилки и DSB и может убивать BRCA -дефицитных клеток, стратегия, которая используется для лечения онкологических пациентов с BRCA мутациями 109 . Истощение FAM111A сенсибилизирует клетки к нирапарибу и талазопарибу 51 , двум ингибиторам PARP с высокой улавливающей способностью 108,110 . Обработка нирапарибом снижает скорость репликационной вилки в клетках, истощенных по FAM111A, и вызывает репликационный стресс.Восстановление дефекта репликации зависит от каталитических остатков FAM111A, PIP-бокса и связывания ДНК, подразумевая, что FAM111A использует свою протеолитическую активность для устранения препятствий, создаваемых захваченным PARP-1 для репликационных вилок 51 (рис. 4B). Остается установить, участвуют ли другие протеазы в удалении прочно связанных белков.
Chk1: Деградация несшитого субстрата повторяет удаление DPC: в любом случае протеолиз устраняет потенциальные препятствия для репликации ДНК и метаболизма, которые угрожают жизнеспособности клеток 51,104 .Поразительным контрастом является расщепление киназы контрольной точки Chk1 с помощью SPRTN во время синтеза ДНК 59 . Во время S фазы SPRTN расщепляет Chk1 на хроматине в слабо структурированной области на C-конце и высвобождает усеченные N-концевые фрагменты Chk1 с более сильной киназной активностью, чем полноразмерный белок 59 (Fig. 4C). Таким образом, SPRTN обеспечивает базальную и физиологическую активацию Chk1, чтобы поддерживать прогрессию репликации ДНК в отсутствие экзогенного повреждения, т.е. в отсутствие нарушений, которые вызывают накопление оцДНК и устойчивый ATR-зависимый каскад активации Chk1 59,111 .Сверхэкспрессия N-концевых фрагментов Chk1 восстанавливает нормальную репликацию ДНК в SPRTN-истощенных клетках (т.е. скорость репликационной вилки и запуск ориджина) и частично устраняет дефекты развития SPRTN -дефицитных эмбрионов рыбок данио 59 .
Помимо раскрытия важной роли Chk1 во время невозмущенной репликации, это исследование также показывает, что функция протеаз DPC выходит далеко за рамки протеолиза барьеров репликационной вилки.
DPC протеазы и болезни
Дефектная репликация ДНК, часто называемая стрессом репликации ДНК, является одной из основных причин рака 112,113,114 .Стресс репликации ДНК может быть вызван препятствиями перед вилкой репликации, например, вызванными сшитыми или прочно связанными белками. Поскольку активность протеаз DPC связана с репликацией ДНК, существует сильная ассоциация между дефектными протеазами DPC и заболеваниями человека 40,57,60 .
Синдром Рюйса-Алфса (RJALS)
Двуаллельные и моногенные мутации в SPRTN вызывают редкое аутосомно-рецессивное прогероидное заболевание, известное как RJALS 60 .Это было первое заболевание, связанное с дефектной репарацией протеолиза DPC. Мутации с потерей функции, выявленные у пациентов до сих пор, представляют собой миссенс-мутацию, которая генерирует каталитически неактивный вариант SPRTN-Y117C, и несмысловые мутации, которые генерируют усеченный SPRTN, SPRTN-ΔC (рис.2), который сохраняет частичную функциональность. из-за интактной протеазной активности, но с дефектной клеточной локализацией 4,5,57,60 . У пациентов с RJALS проявляются признаки преждевременного старения, включая катаракту, поседение волос, липодистрофию, и у них развивается гепатоцеллюлярная карцинома с ранним началом (ГЦК) 60 .Эти фенотипы были повторены у гипоморфных мышей SPRTN 57,115 и окончательно доказывают, что дефектный SPRTN сам по себе ответственен за фенотип RJALS.
Старение и рак кажутся противоречивыми проявлениями, но на самом деле это два результата одних и тех же основных клеточных дефектов — накопление повреждений ДНК и геномная нестабильность 116,117 . Клетки пациентов с RJALS (линии лимфобластоидных клеток и фибробласты, полученные от пациентов) демонстрируют стресс репликации ДНК, утечку G2 / M, повышенное количество DSB, хромосомные аберрации и повышенный уровень общих DPC.Непонятно, почему у людей и мышей развивается ГЦК, в то время как остальная часть тела стареет.
Синдром Кенни-Каффи типа 2 (KCS2) и дисплазия тонкой кости (GCLEB)
Мутации FAM111A вызывают KCS2, редкое аутосомно-доминантное заболевание, характеризующееся низким ростом, гипопаратиреозом, гипокальциемией и аномальным развитием костей. У пациентов с KCS2 нет предрасположенности к развитию рака 118119 . Гетерозиготные мутации в FAM111A также были обнаружены у пациентов с GCLEB или остеокраниостенозом 119 .GCLEB смертелен для новорожденных из-за серьезных аномалий скелета.
Мутации, вызывающие KCS2 и GCLEB, изменяют протеолитическую активность FAM111A. Замена R569 на гистидин (H) является повторяющейся мутацией в KCS2 118,119 и находится в непосредственной близости от каталитического остатка S541 (рис. 2). FAM111A-R569H и другие вызывающие заболевание мутации усиливают саморасщепление FAM111A in vitro, показывая, что они представляют собой мутации с усилением функции 51,52 . Экспрессия FAM111A-R569H или других мутировавших вариантов вызывает дефекты репликации и транскрипции и апоптоз 52,61,77 .Таким образом, кажется правдоподобным, что токсичность гиперактивного белка возникает из-за неконтролируемой деградации белков репликации и транскрипции (например, RFC, Rpb1) 52 ; однако неизвестно, как эти мутации приводят к наблюдаемым фенотипам.
Опухоли детских зародышевых клеток (GCT)
Мутации в GCNA связаны с GCT. Подавление экспрессии GCNA — из-за потери числа копий и гиперметилирования промотора — обнаруживается в 66% GCT 40 и коррелирует с плохим прогнозом.Эти изменения в GCT показывают, что протеаза GCNA имеет решающее значение для геномной стабильности половых клеток.
Пандемия означала тяжелые времена для тех, кто любит деньги
Гейл Ваз-Окслейд
11 февраля 2021 г.Не так давно наличные деньги считались разумным способом сбережения и составления бюджета.
Кто может забыть просмотр великолепного сериала ‘Til Debt Do Us Part с участием Гейл Ваз-Окслейд, где ключевым уроком по управлению семейным бюджетом было копить сдачу и счета в банках, одну банку на еду, одну на топливо , один для развлечения и т. д.Банки с наличными вынуждали вас соблюдать бюджет, а использование кредитных карт и кредитных линий было запрещено.
А как насчет совета американского финансиста Марка Кьюбана по поводу сделок с наличными деньгами — он отмечает, что «вы добьетесь лучших результатов, если будете вести переговоры с наличными деньгами». Например, если вы скажете: «Все, что у меня есть, это 40 долларов наличными», возможно, продавец согласится на это, а не на более высокую сумму. Такой возможности для маневра не существует с кредитными и дебетовыми картами.
Но пришла пандемия, заставившая мир содрогнуться от наличных денег.
«Все больше предприятий переходят на безналичный расчет во время пандемии COVID-19 и просят клиентов использовать дебетовые, кредитные платежи или платежи через приложения в качестве меры предосторожности», — отмечает CBC. Некоторые розничные торговцы вообще отказываются принимать наличные, другие обращаются с ними более безопасным способом, используя щипцы и маленькие кассовые боксы.
Проблема с наличными деньгами, конечно же, связана со здоровьем; передача счетов и наличных — это действие из рук в руки, которое сопряжено с риском. Бесконтактные платежи считаются более безопасными.
В U.К., бесконтактные платежи выросли на 64% от всех транзакций, сообщает MSN Money .
Крупный розничный торговец Asda теперь принимает платежи с более широкого спектра мобильных устройств, а лимиты бесконтактных платежей, которые когда-то были довольно небольшими, были увеличены, отмечается в статье. Теперь лимит составляет 45 фунтов — около 78 канадских долларов.
Здесь, дома, NFCW сообщает, что лимиты Visa и MasterCard для бесконтактных платежей подскочили до 250 долларов.
Последний показатель безналичного общества — использование банкоматов.В Великобритании сообщает PA Media через MSN. Использование банкоматов снизилось на 60%.
«Когда люди действительно пользуются банкоматом, они обычно снимают больше денег. В настоящее время средняя сумма снятия наличных в банкомате составляет около 80 фунтов стерлингов, по сравнению с 65 фунтами стерлингов до блокировки », — отмечается в статье.
Семьдесят пять процентов опрошенных британцев говорят, что в наши дни они используют меньше наличных денег, а 14 процентов говорят, что они хранят все накопленные деньги дома, возможно, в копилке, на случай чрезвычайных ситуаций, говорится в статье.
Итак, King Cash свергнут, по крайней мере, до тех пор, пока пандемия не закончится. Несомненно, однажды, когда пандемия окажется под контролем, трон вновь займет трон, и можно будет делать покупки с кошельком, заполненным купюрами и монетами.
Накапливаются деньги? Хотя сохранить его на случай чрезвычайной ситуации — отличная идея, так же как и на пенсию. В наши дни не так много людей выстраиваются в очередь у этих зеленых счетных машин, поэтому принесите туда свою копилку монет и конвертируйте ее в купюры.Затем их можно заправить на свой сберегательный счет через банкомат.
Пенсионный план Саскачевана имеет отличную функцию «сначала плати себе», о которой стоит знать. Вы можете настроить SPP как счет в большинстве приложений онлайн-банкинга. Затем вы можете положить эти доллары-копилки в свой SPP так же легко, как и оплатить счет за кабельное телевидение. Не член СПП? Ознакомьтесь с ними сегодня — в 2021 году им исполнится 35 лет с момента предоставления пенсионного обеспечения.
Мартин Бифер — старший писатель по пенсионным вопросам в Avery & Kerr Communications в Непине, Онтарио.Ветеран-репортер, редактор и специалист по пенсионным вопросам, теперь он фрилансер. Увлекается гольфом, линейными танцами и классическим роком , а также игрой на гитаре. Есть идея для рассказа? Сообщите Мартину об этом через LinkedIn.
19 июля 2018 г.
Гейл Ваз-Окслейд, известный писатель, блогер и телеведущий, предоставляет именно то лекарство, которое нам нужно, если мы наткнулись на ужасное минное поле долгов.
Эта книга напоминает вам о том, как вы с кепкой в руке ходили к родителям в надежде на помощь с счетами, а вместо этого читали лекцию о том, как вам самому решать свои проблемы.Как говорится в книге, простого выхода из долговой ловушки нет. Debt-Free Forever предоставляет подробный, пошаговый план для вашего личного государственного корабля. Так что, если вы сидите на кучу долгов и начинаете чувствовать дискомфорт, ваши люди будут рады услышать, что вы взяли в руки эту книгу.
Великолепный текст и тон этой книги «мы все прошли через это, и мы можем это исправить» очень воодушевляют и вдохновляют вас на то, чтобы помочь себе выбраться из собственной неприятности. Пример: «Хорошая идея — установить визуальное напоминание о том, над чем вы работаете.Вырежьте изображение дома, которым хотите владеть, и повесьте его на холодильник », — пишет Ваз-Окслад.
Здесь много богатого контента. В первых четырех главах рассказывается о том, как «понять, где вы стоите» с точки зрения долга, составить план выхода из него, изменить свои привычки (самая сложная часть) и запланировать будущее. Хотя это звучит просто, это требует много работы, самоотверженности и сосредоточенности, но в книге все изложено так, чтобы вы могли следовать.
Что касается экономии, Vaz-Oxlade рекомендует правило 10 процентов.«Возьмите 10 процентов вашего ежемесячного чистого дохода… и положите их в свои долгосрочные сбережения (например, пенсионный план)», — пишет она. Для тех, кто говорит, что они не могут позволить себе сберегать, потому что не зарабатывают достаточно, имеют слишком много долгов или «хотят жить сегодняшним днем, дружище», Ваз-Окслейд говорит о Законе инерции.
«Сохранять статус-кво намного легче, чем менять. Дело в том, что вы не сможете сэкономить 10 000 долларов, пока не сэкономите 1 000 долларов. Вы не сможете сэкономить 1000 долларов, пока не сэкономите 100 долларов. Вы не можете сэкономить 100 долларов, пока не сэкономите 10 долларов.”
Начинайте с малого, советует она, делайте сбережения автоматическими и постепенно увеличивайте сбережения. Эта отличная книга поможет вам изменить положение дел в вашей финансовой жизни. Это опубликовано Коллинзом.
И как только вы встанете на путь, пенсионный план Саскачевана станет отличным местом для внесения регулярных автоматических взносов в ваши долгосрочные пенсионные сбережения. Ознакомьтесь с SPP сегодня на сайте www.saskpension.com.
| Автор Мартин Бифер | |
| Мартин Бифер — старший писатель по пенсионным вопросам в Avery & Kerr Communications в Непине, Онтарио.После 35-летней карьеры репортера, редактора и консультанта по пенсионным вопросам Мартин наслаждается жизнью писателя-фрилансера. Он посредственный игрок в гольф, многообещающий игрок в дартс и начинающий танцор, увлекающийся классическим роком и спортом, особенно футболом. Он и его жена Лора живут со своим Шелти Дунканом и их котом Тубинсом. Вы можете следить за ним в Твиттере — его псевдоним @ AveryKerr22 | .|
18 апреля 2016
Шерил Смолкин
Мы вернулись, и вам есть чем поделиться! Мы взяли двухмесячный перерыв, но наши любимые блогеры все еще усердно работали.Так что у нас есть много замечательных историй, о которых мы можем рассказать вам в ближайшие недели.
Первый федеральный бюджет либерального правительства был представлен в прошлом месяце. Он устранил некоторые меры, принятые консерваторами, а другие будут постепенно отменены. На сайте Financial Independence Hub Пол Филлипс из компании Financial Wealth Builders излагает точку зрения финансового планировщика на бюджет на 2016 год. Одним из сюрпризов, которые он отмечает, является устранение отсрочки налогообложения при переключении фондов в корпорации взаимных фондов.
Важность отсутствия высокого кредитного рейтинга может не проявиться до тех пор, пока вы не подадите заявку на получение кредитной карты или ипотеки, и вам будет отказано или не одобрено на получение необходимой суммы. Бриджит Истгаард, ведя блог о деньгах после окончания учебы, обсуждает пять простых шагов для создания хорошей кредитной истории. Поскольку 18% кредитных отчетов содержат ошибки, она регулярно проверяет свой кредитный отчет, чтобы убедиться, что платежи по ее студенческому кредиту были правильно зарегистрированы, что кредитные карты не были открыты на ее имя из-за кражи личных данных, и что компании выполнили ее запросы на закрытие кредитных счетов. .
Робб Энген — хорошо известный блогер в Boomer & Echo. За эти годы он поделился множеством идей о том, как более эффективно зарабатывать и экономить деньги. Хотя он не поощряет звонки из офиса по вечерам и в выходные дни, он говорит, что это честная сделка, потому что его работодатель оплачивает его счет за мобильный телефон. Фактически, по его оценкам, он сэкономил более 9500 долларов за последние 12 лет (144 месяца x 66 долларов в месяц), потому что в серии работ за этот период он ни разу не потратил ни копейки из собственного кармана на тарифный план сотового телефона. .
По мере того, как баланс в вашем RRSP со временем растет, может быть трудно устоять перед соблазном использовать свое «гнездовое яйцо» в чрезвычайной ситуации или просто потому, что вам «нужно» что-то, что выходит за рамки вашего текущего бюджета. Сара Милтон из Retire Happy приводит три веские причины, по которым вывод денег из вашего RRSP до выхода на пенсию — не лучшая идея.
И, наконец, знаток личных финансов Гейл Ваз-Окслейд недавно объявила, что вела свой последний блог. Хотя мы знаем из личного опыта, что вести блог неделя за неделей может быть непросто, ее поклонники (в том числе и я) будут упускать из виду ее неизменно отличный совет.К счастью, большинство архивных блогов неподвластны времени.
Итак, для тех из вас, кто подумывает о покупке дома этой весной, мы даем ссылку на одну из ее лучших статей. Она приводит отличный аргумент в пользу того, чтобы сэкономить немного времени на первоначальный взнос, вместо того, чтобы запереться в платежах по ипотеке, которые душат ваш денежный поток, пока вы платите непомерные суммы процентов и страховых взносов.
*****
Следите ли вы за блогами с потрясающими идеями экономии денег, которые не были упомянуты в нашем еженедельнике «Лучшее из блогосферы?» Поделитесь с нами информацией на http: // wp.me / P1YR2T-JR и ваше имя будут участвовать в ежеквартальном розыгрыше подарочной карты.
1 февраля 2016 г.
26 октября 2015 г.
Шерил Смолкин
Пока я пишу это, возможно, самым ярким событием прошедшей недели были выборы нового премьер-министра либералов Джастина Трюдо. Но пройдут недели и месяцы, прежде чем мы узнаем, какое влияние смена правительства окажет на нашу повседневную жизнь и канадскую экономику.
Итак, сегодня мы возвращаемся к основам и опираемся на труды многих из наших любимых блоггеров по личным финансам и ведущих медийных экспертов, которые изо дня в день публикуют статьи, которые помогают нам лучше управлять своими деньгами.
Мысль о безработице пугает, но велика вероятность, что это случится с вами или вашим близким хотя бы раз в жизни. В книге «Деньги, которые у нас есть» Барри Чой пишет о том, как подготовиться к безработице. Он предлагает вам иметь запасной фонд; побочная суета, и вы улучшите свои навыки.
Гейл Ваз-Окслейд решает проблему воспитания детей с ограниченным бюджетом. Она говорит, что уловка, позволяющая не допустить, чтобы детские расходы вышли из-под контроля, состоит в том, чтобы выделить определенную сумму на деятельность и потребности каждого ребенка и придерживаться плана. Начните с перечисления всего, чем занимаются ваши дети, на которые вы должны выложить часть своих с трудом заработанных денег.
Кристал Йи является вегетарианкой уже почти два года. Она делится на «Верни мне мои пять баксов» за месячный эксперимент перехода от вегетарианца к вегану.Она ожидает более высоких, чем обычно, счетов за продукты и того, что ей будет сложно изменить ее привычки, но она надеется, что один месяц превратится в два месяца, и результатом станет новый образ жизни.
Если вам интересно, куда уходят ваши деньги, вам понравится «Крутые годы: куда уходят деньги» Мэтт МакКлерн на MoneySense. Макклерн отслеживал каждый цент, который он потратил, в цифровом виде за последние 12 лет. Он говорит, что транспорт и детский сад серьезно сказались на бюджете, но лучшее финансовое решение, которое он когда-либо принял, — это агрессивно выплачивать ипотеку.
И в Huffington Post Прамод Удиавер обсуждает пять основных тенденций, которые повлияют на то, как вы выходите на пенсию. Они увеличивают продолжительность жизни; нижняя возвратная среда; меньшее количество пенсионных планов с установленными выплатами; и растущие расходы на здравоохранение.
Следите ли вы за блогами с потрясающими идеями экономии денег, которые не были упомянуты в нашем еженедельнике «Лучшее из блогосферы?» Поделитесь с нами информацией на http://wp.me/P1YR2T-JR, и ваше имя будет участвовать в ежеквартальном розыгрыше подарочной карты.
30 июля 2015 г.
Шерил Смолкин
Я не часто рецензирую книги по личным финансам, потому что, кажется, требуется слишком много времени, чтобы проработать еще одно очевидное утверждение, просто чтобы собрать достаточно убедительную информацию, чтобы дать читателям почувствовать, о чем эта книга.
Но когда я прочитал похвалы от таких людей, как Гейл Ваз-Окслейд, Прит Баннерджи, Рома Люциу, Дэн Бортолотти и целой группы других моих любимых блоггеров по личным финансам на вводных страницах книги, я подумал, что лучше продолжу собираюсь выяснить, о чем идет речь.
Автор Роберт Р. Браун говорит, что Wealthing Like Rabbits написано как забавное и уникальное введение в личные финансы и предполагает, что любая книга, которая включает секс, зомби и упоминание о капитане Пикарде, является «абсолютно обязательной к прочтению», независимо от того, жанр.
Браун начинает с вопроса, сколько кроликов было бы через 60 лет, если бы 24 кролика были выпущены на ферме на большом большом острове. Прежде чем дать ответ на этот вопрос, он говорит о необходимости откладывать на пенсию, хотя и не начинает предсказывать, сколько вам или мне понадобится.Его единственный вывод состоит в том, что «больше — лучше», потому что лучше быть 65 годам с накопленными 750 000 долларов, чем 65 годам с накопленными 75 000 долларов.
Затем он показывает, что через 60 лет будет 10 миллиардов кроликов, и начинает обсуждение истории и ключевых особенностей зарегистрированных пенсионных накопительных планов (RRSP) и необлагаемых налогом сберегательных счетов (TFSA). Впоследствии он рассуждает о том, сколько зомби было бы в Англии, если бы Франция отправляла 100 зомби в неделю в течение 40 лет.
Если вы все еще со мной, вы можете задаться вопросом — в чем смысл всего этого?
Конечно, неудивительно, что он призван продемонстрировать силу сложения, будь то по отношению к кроликам, деньгам или зомби.Мы узнаем, что всего 100 долларов в неделю, вложенные в RRSP с доходом 6% в течение 40 лет, составят в сумме 624 627 долларов.
Но и положительные, и отрицательные последствия начисления сложных процентов также очень умно показаны в следующих главах. Мне особенно понравилось сравнение братьев Марио и Луиджи, у которых были одинаковые доходы и 100 000 долларов в качестве первоначального взноса за дом. Они пошли в банк, чтобы узнать, на какой размер ипотеки они имеют право.
Банкир Марио сказал ему, что «он может позволить себе» купить дом за 525 000 долларов.Луиджи сказал специалисту по ипотеке, что ему нужно 10 000 долларов на покрытие расходов, а остаток в 90 000 долларов должен был покрыть не менее 20% покупной цены дома, поэтому максимальная сумма, которую он готов потратить, составляет 450 000 долларов.
История продолжается, когда Марио купил дом площадью 3000 квадратных футов за 525000 долларов. Луиджи придерживается своего бюджета и покупает дом площадью 1600 квадратных метров за 350 000 долларов. Более 20 лет сложные проценты по ипотеке означают, что Марио в конечном итоге платит 807 538 долларов за свой дом, в то время как Луиджи остается только раскошелиться на 538 359 долларов.
Точно так же, когда дело доходит до долга, Браун показывает, что задолженность по кредитной карте с высокими процентами может быстро увеличиваться, если остатки не выплачиваются каждый месяц. Даже я до недавнего времени не осознавал, что если вы пропустите срок платежа хотя бы на один день, беспроцентный льготный период полностью исчезнет. Фактически, вы должны платить проценты на сумму каждой транзакции с даты совершения каждой покупки.
Brown также рассматривает характеристики кредитной линии; кредитная линия домовладельца; банковские ссуды и ссуды на консолидацию.Хотя в целом он считает, что все это может нанести серьезный ущерб вашему финансовому здоровью, он признает, что при правильном обращении каждое из них имеет свое место.
Но он проводит черту на песке, когда дело доходит до ссуд до зарплаты. «Никогда, никогда не получи ссуду до зарплаты», — говорит Браун.
Он приводит пример Бадди, который берет взаймы 400 долларов в ссуде до зарплаты, потому что его печь сломалась. С него берут 21 доллар за каждые 100 долларов, которые он берет в долг всего на две недели. Две недели спустя он платит кредитору 484 доллара.Это 21% всего за 14 дней, что составляет 546% ежегодно. И это только начало.
Если Бадди не сможет заплатить в течение двух недель, кредитная компания взимает с него штраф NSF и продолжает накапливать заоблачные процентные ставки на всю сумму. Дальнейшие нарушения означают, что его, скорее всего, будут преследовать по телефону дома и на работе днем и ночью. Дело может быть передано еще более агрессивному коллекторскому агентству.
Во второй последней главе Браун предлагает кучу финансовых советов (которые он не называет «Пятьдесят оттенков коричневого»):
- Супружеские RRSP крутые. Журнал
- MoneySense — отличный источник информации о личных финансах.
- Поужинайте дома. Затем сходите на кофе и перекусите в Starbucks.
- Покупайте в банке страхование жизни, а не ипотечное страхование.
- Прочтите книгу Прита Банерджи « Хватит чрезмерно думать о своих деньгах» для худых по страхованию жизни.
- Используйте существительное «богатство» в качестве глагола. Таким образом, вместо того, чтобы экономить 150 долларов в неделю в вашем RRSP, вы будете растрачивать свои деньги.
И, наконец, напутствие Брауна в конце книги звучит так: «Тебе нужно явиться.«Положите немного денег на свое будущее. Живите в доме, который имеет смысл. Будьте осторожны в том, как вы тратите свои деньги. Тратьте меньше, чем зарабатываете. Будьте комфортны, живя по средствам. Он говорит, что на самом деле — это так просто.
Wealthing Like Rabbits — это забавно и увлекательно, и оно поражает все базы личных финансов. Независимо от того, являетесь ли вы миллениалом, представителем поколения X или бумером, вы найдете множество советов о том, как сэкономить больше, тратить меньше и при этом весело провести время.
Книгу можно приобрести в твердом переплете за 16,95 доллара, а версии epub и kindle — за 7,99 доллара.
18 мая 2015 г.
Шерил Смолкин
За последние несколько недель Globe & Mail опубликовал интересную серию статей о долге и о том, как он влияет как на людей, так и на экономику. Если вы не следили за ним, взгляните на некоторые из историй ниже:
Пристрастие к риску: анализ государственного долга Канады
Глубоко: высокие риски растущей зависимости Канады от долгов
Вы тонете в долгах? Посмотрите, как вы сравниваете с другими канадцами
Лори Кэмпбелл: генеральный директор Credit Canada разрушает долговые мифы
Мне особенно нравится статья Роба Каррика «Хороший долг не бывает».Ипотека, инвестиционные ссуды и студенческие ссуды традиционно характеризовались как «хорошая» задолженность. Кэррик соглашается, что заимствование для каждой из этих целей может быть разумным поступком, и в результате вы можете стать более богатым. Но он приходит к выводу, что сегодня существует слишком много подводных камней, чтобы любую из них можно было квалифицировать как финансовое решение без каких-либо проблем.
Big Cajun Man (Алан Уиттон) из журнала Canadian Personal Finance перечисляет несколько статей о вреде долга среди своих любимых статей. В 2008 году он написал, что «Долг подобен толстому».Он говорит, что точно так же, как его прибавка в весе происходила понемногу в течение 14 лет, если вы не будете осторожны, рост долга может происходить медленно, и вы этого не заметите.
Если вы столкнулись с огромной задолженностью и не знаете, с чего начать, взгляните на статьи «Как я выплатил 30 000 долларов долга за два года», «Сообщение в блоге, которое я ждал написать» и «Какой год быть долгом». -Free Has Taught Me Кейт Фландерс, которая ведет блог на сайте Blonde с ограниченным бюджетом.
В 2013 году Кристал Йи в «Верни мне мои пять баксов» написала «Как бороться с долговой усталостью?».Долговая усталость — это психическое состояние, которое может произойти, если вы так долго были в долгах, что вам кажется, что вы никогда не выберетесь из ямы, которую вы себе создали. Она цитирует финансового эксперта Гейл Ваз-Окслейд, которая часто говорит людям в своих телешоу, чтобы они попытались составить план, как выбраться из долгов за 36 месяцев или меньше, потому что если вы выберете более трех лет, вы, вероятно, будете страдать от какой-либо формы долговая усталость.
И, наконец, в гостевом посте в блоге Canadian Finance Джим Йих из Retire Happy написал, что долг может стать проблемой для пенсионных планов бэби-бумеров.Он говорит, что бэби-бумеры, готовящиеся к выходу на пенсию, должны серьезно задуматься о лучших годах своей жизни. Отчасти серьезным является решение проблемы долга и принятие необходимых мер для развития хороших привычек в отношении долга. Его пять советов о том, как бумеры могут справиться с долговой эпидемией: прекратить перерасход средств; увеличить свой доход; получать поддержку; сосредоточьтесь на себе раньше ваших детей; и делайте шаг за шагом.
Следите ли вы за блогами с потрясающими идеями экономии денег, которые не были упомянуты в нашем еженедельнике «Лучшее из блогосферы?» Поделитесь с нами информацией на http: // wp.me / P1YR2T-JR и ваше имя будут участвовать в ежеквартальном розыгрыше подарочной карты.
19 января 2015
Шерил Смолкин
Если вы каждый год максимально увеличиваете свои взносы в SPP, вы знаете, что ваши деньги вкладываются в простой для понимания сбалансированный фонд. Однако, когда вы пополняете свои сбережения взносами в пенсионные планы на рабочем месте или в свой личный RRSP, часто бывает сложно понять, как вложить свои деньги.
В блоге Tangerine Bank «Перспективное мышление» Прит Баннерджи предлагает отложить ваши взносы в RRSP, чтобы уложиться в срок. Деньги просто остаются там, «припаркованные» внутри RRSP как инвестиции с низким уровнем риска, пока вы не будете готовы в этом разобраться. Некоторые люди могут не осознавать, что инвестиции в RRSP могут быть изменены позже.
В моем 2014 (и окончательном) портфеле доходности Boomer & Echo Робб Энген признает, что его дивидендные акции не соответствовали средней рыночной доходности в прошлом году, поэтому он, наконец, укусил пулю и продал «своих младенцев», заменив их простой двухфондовой решение.
С другим подходом к пассивному инвестированию Holy Potato выпустил свой «Канонический портфель», простой рецепт четырех фондов или ETF для вашего портфеля. Он представляет портфель из четырех фондов (облигации плюс три класса акций) с простым практическим правилом для определения основного разделения.
Сара Милтон специально обращается к инвестиционной дилемме, с которой сталкиваются люди, сберегающие в рамках групповых пенсионных планов на Retire Happy. Она представляет 3 варианта инвестирования для пассивных групповых инвесторов, включая гарантированные инвестиции, фонды распределения активов и фонды целевой даты.
И, наконец, пост Гейл Ваз-Окслейд How Do You Stack Up? отсылает читателей к инструменту на веб-сайте Royal Bank, который измеряет ваши показатели по сравнению с вашим регионом и Канадой в целом, когда речь идет о вашем доходе и чистой стоимости. Хотя приятно получить оценку того, как у вас дела, она говорит, что сравнение ваших результатов с результатами других ничего не значит, если вы не имеете дело с подобными обстоятельствами.
Следите ли вы за блогами с потрясающими идеями экономии денег, которые не были упомянуты в нашем еженедельнике «Лучшее из блогосферы?» Поделитесь с нами информацией на http: // wp.me / P1YR2T-JR и ваше имя будут участвовать в ежеквартальном розыгрыше подарочной карты.
13 января 2015 г.
Шерил Смолкин
Нажмите здесь, чтобы послушать
Привет, сегодня я начинаю серию интервью с подкастами экспертов SavewithSPP.com 2015 года. Я рада, что Гейл Ваз-Окслейд нашла время в своем плотном графике, чтобы поговорить с нами.
Гейл действительно знаток денег в Канаде. Она проработала в сфере финансовых услуг 25 лет в качестве писателя, телеведущей, оратора и официального представителя корпорации.За последние несколько десятилетий она опубликовала 15 книг по личным финансам, четыре из которых одновременно входили в список бестселлеров в январе 2012 года.
Она также сняла почти 200 эпизодов своих телевизионных программ, Til Debt Do Us Part, Princess and Money Moron. Кроме того, она регулярно ведет блог и отвечает на вопросы читателей на gailvazoxlade.com.
Но сегодня я хотел бы поговорить с ней о mymoneymychoices.com, онлайн-программе повышения финансовой грамотности, которую она основала чуть больше года назад.
Добро пожаловать, Гейл.
Привет, спасибо, что пригласили меня.
В: Итак, Гейл, как вы определяете финансовую грамотность? Насколько серьезна проблема отсутствия финансовой грамотности в этой стране?
A: Проблема сама по себе огромна, потому что большинство людей уже знают большую часть того, что им нужно знать, но не делают этого.
В: Вы описываете mymoneymychoices.com как первую в Канаде комплексную программу финансовой грамотности, разработанную для повышения денежного IQ канадцев за счет поддержки сообщества, надежной финансовой дорожной карты и геймификации для подкрепления.Как вы пришли к этой концепции?
A: На самом деле я был между телешоу. У меня было много свободного времени, и я прочитал об организации в США, которая использовала положительное давление со стороны сверстников, чтобы изменить поведение. Итак, я изложил эту дорожную карту всего, что вам нужно сделать, в том порядке, в котором, как я думаю, вам нужно это делать, чтобы построить прочную финансовую основу.
В: Каковы ваши цели в программе?
A: На самом деле я хочу, чтобы люди перестали говорить: «Я не знаю, с чего начать.«Если вы зайдете на сайт mymoneymychoices.com и зарегистрируетесь — это абсолютно бесплатно — и просто примете меры, указанные в программе, вы проложите себе путь к финансовому благополучию. Я хочу, чтобы люди объединялись в сообщества и поддерживали друг друга, учили друг друга и работали вместе, чтобы повысить финансовую грамотность своего сообщества.
В: Вы говорите, что первый уровень самый сложный. Почему?
A: На первом уровне, который, как я сказал, имеет всю тяжелую работу; вам необходимо провести анализ расходов за шесть месяцев.Вы также создаете план погашения долга, чтобы ваш потребительский долг был выплачен в течение 3 лет или меньше. Вы должны составить бюджет и сделать свой первый отчет о чистой стоимости активов. И очень часто я обнаруживаю, что люди не понимают, зачем нужны эти детали. Я все время говорю людям: если вы делаете заявление о собственном капитале сегодня, и оно выглядит очень мрачно, это не имеет значения, потому что это не то место, где вы находитесь сегодня. Насколько все будет иначе, когда вы сделаете это через полгода во второй раз.
В: Есть ли у вас спонсоры или партнеры? Или вы несете единоличную ответственность за расходы на разработку и обслуживание сайта?
A: Мне бы хотелось, чтобы спонсоры поддержали нас, но дело в том, что всякий раз, когда вы присоединяетесь к кому-либо, обычно происходит то, что они говорят о том, что вы делаете.Так что я взял на себя расходы по разработке сайта и основал фонд «Мои деньги — мой выбор», куда я принимаю пожертвования. В конце 2014 года я провел кампанию на Indiegogo и собрал 3785 долларов.
В: Мои деньги — мой выбор, нацелены на какой-либо конкретный возраст или демографию?
A: Нет, это не так. На самом деле не имеет значения, 23 вам или 43 года. Если вы не знаете, куда уходят ваши деньги, то это первое, с чего вам нужно начать. Если вы уже сделали все это, вы можете просто выбрать их в программе, пока не дойдете до уровня, на котором вы внедряете что-то новое для себя.Например, это может быть уровень, на котором вы исследуете страхование по инвалидности и страхование жизни
Q: Расскажите вкратце, как работает программа. Я вижу, что есть таблица лидеров и разные призы и уровни.
A: Призы действительно иконы. Это то, что вы можете использовать, чтобы показать миру, где вы находитесь и как продвигаетесь по ступеням.
В: Что такое элемент сообщества? Судя по тому, что я прочитал на сайте, вы не можете сделать это самостоятельно. Вы должны быть частью племени или команды.
A: Вы можете сделать это самостоятельно, потому что любой может использовать дорожную карту. Однако если вы работаете в племени, тогда вы получаете выгоду от поддержки, которая приходит вместе с этим. Когда все сообщество вас подбадривает или пинает вам задницу, в зависимости от того, что вам нужно в этот день, у вас гораздо больше шансов снова сесть на лошадь, если вас оттолкнет. Это часть цели сообщества.
С другой стороны, некоторые люди в сообществе очень хороши в одних вещах, а другие — в других.И когда вы собираете все это вместе, вы создаете сплоченность вместе с процессом вместе с навыками управления. Когда вы объединяете все это вместе, вы делаете это намного сильнее, чем каждый человек, пытающийся сделать все в одиночку.
В: Какую роль играет наблюдатель?
A: Наблюдатель — первый парень, проводящий обучение. Обычно наблюдатель — это тот, кто имеет некоторый опыт в деньгах, независимо от того, является он официальным или нет. И работа этого человека состоит в том, чтобы помочь первым нескольким людям пройти первый уровень, а затем направить тех же людей через различные другие уровни и побудить их привлечь больше людей в племя, чтобы они могли стать учителями и наставниками своих собственных протеже.В конечном итоге наблюдатель будет управлять всем процессом и сказать: «Хорошо, вот как мы делаем это как сообщество».
В: Если группа людей хочет собраться вместе и принять участие в вашей игре на вашем веб-сайте, нужно ли им иметь наблюдателя или кто-то становится наблюдателем, потому что он первым проходит уровни?
A: Приведу пример. Несколько недель назад меня пригласили выступить перед церковной общиной в Торнхилле, и я согласился, если они учредят племя My Money My Choices как часть процесса.Джентльмен по имени Эмилио, который идет полным ходом, потому что он следил за мной в течение многих лет, стал наблюдателем за этой церковной общиной. Он создал страницу в Facebook, чтобы люди могли общаться друг с другом. Он позаботился о том, чтобы в библиотеке были книги, чтобы ресурсы были доступны на случай, если людям понадобится помощь в составлении бюджета или проведении анализа расходов. Он выполнял все административные и вспомогательные работы, чтобы убедиться, что, когда люди начинают участвовать в программе, их не отвлекают мелкие проблемы.
В: Это действительно здорово. Итак, это 23 уровня. Не могли бы вы привести мне несколько примеров того, что участники узнают по мере прохождения различных уровней?
A: Конечно. Самый первый уровень, как я уже сказал, самый сложный, потому что он закладывает основу для всего остального. После того, как вы закончите первый уровень, вы перейдете к тому моменту, когда начнете внедрять процесс. Вы используете журнал расходов. Вы вносите средства в свой бюджет каждый месяц. Вы знаете, куда уходят ваши деньги.По мере продвижения вверх вы также начинаете вкладывать деньги в сбережения. Вам выплачивают свой долг. В конечном счете, причина состоит в том, что существует 23 шага, потому что я не ожидаю, что люди перейдут от 0 до 100 за 12,2 секунды. Это требует времени.
В: Итак, вы говорите, что у вас на сайте зарегистрировалось 8000 человек. Сколько из них прошли все уровни?
A: Пока никого. Потому что на последнем уровне вы максимизируете свой RRSP, вы выплатили ипотечный кредит, вы увеличиваете свой сберегательный счет, не облагаемый налогом, и выплачиваете весь свой потребительский долг.Это процесс. Вы постепенно улучшаете свое финансовое положение, очень, очень маленькими шагами.
В: Есть способы заработать дополнительные баллы. Что вы делаете с этими очками? Что они для тебя делают?
A: Это очень интересное явление. Одно из исследований показывает, что точки сами по себе — это то, чего хотят люди. Их не волнует, во что переводятся баллы. Это человеческая природа. Нам нравится собирать вещи. Нам нравится накапливать вещи.Мы измеряем свой успех в баллах. Нам нравится балльная система.
В: Что люди делают, чтобы заработать дополнительные баллы?
A: Идея заключается в том, что каждый раз, когда вы публикуете сообщение в журнале расходов или переводите журнал расходов в бюджет денежного потока, вы получаете больше баллов. Система вознаграждения основана на действии. Если вы активно участвуете, вы продолжаете накапливать баллы.
Q: Планируете ли вы изменить или улучшить программу?
A: Я не собираюсь касаться программы My Money My Choices в ее нынешнем виде.Я работал над этим около двух лет, прежде чем фактически выложил его. Я думаю, что это охватывает все основы. Если люди пришлют мне хорошие ресурсы, чтобы дополнить его, я буду добавлять эти ресурсы со временем, как только я их проверю. Но на самом деле мне не нужно изобретать что-то заново, если все в порядке и работает. Я хочу использовать часть денег Indiegogo, чтобы обеспечить большее присутствие в Интернете, чтобы помочь людям найти программу.
В: Кажется, у вас всегда на ходу десятки проектов. Есть ли что-то новое и интересное, что вы еще не знаете, о чем вы можете нам рассказать?
A: В январе 2016 года выходит моя новая книга под названием «Разговоры о деньгах, когда говорить« да »и« как сказать нет ».И это будет касаться всех аспектов взаимоотношений с деньгами. Откуда у вас те действительно сложные разговоры, которых люди, кажется, просто избегают? Будь то разговор перед свадьбой или разговор с родителями, потому что они продолжают приставать к вам деньги, а вы совершенно уверены, что у них нет пенсионного плана. Так что все дело в том, чтобы вести эти сложные разговоры и как лучше их расположить.
Q: Большое спасибо за то, что нашли время поговорить со мной сегодня, Гейл.
A: С удовольствием.
–
Подробнее о mymoneymychoices.com и о том, как играть в эту игру, можно узнать здесь. Здесь перечислены все книги Гейл, их можно заказать в магазинах Indigo или Amazon.
11 декабря 2014 г.
Шерил Смолкин
У каждого есть своя собственная система управления семейными финансами, но если у вас большой долг и вы всегда занимаетесь у Питера, чтобы заплатить Полу, вам определенно нужно серьезно составить бюджет.Если вы считаете, что не можете позволить себе откладывать деньги на образование детей или выход на пенсию, внимательное изучение того, как вы тратите деньги, поможет вам найти способы высвободить средства, необходимые для планирования будущего.
Составление бюджета — это не ракетостроение, но оно требует времени и приверженности. В своем телешоу «Til Debt Do Us Part» знаток личных финансов Гейл Ваз-Окслейд помогает барахтавшим семьям, ограничивая их бюджет только наличными и разделяя на банки суммы, которые они могут тратить каждую неделю по каждой категории, включая погашение долга и сбережения .
Все девять сезонов доступны для просмотра в Интернете, а на ее веб-сайте есть дополнительная информация и инструменты для составления бюджета.
Почти каждый блоггер, занимающийся личными финансами, провел серию статей по бюджетированию и создал электронные таблицы с бюджетом, которые вы можете скачать. Например, взгляните на бюджетную серию и инструменты Squawkfox. Джим Йи из Retire Happy также разместил шаблоны из своего семинара Take Control of Your Money.
Когда мы с мужем впервые поженились, денег было мало, и мы тщательно планировали бюджет.Хотя у нас были отдельные банковские счета, у нас был общий счет для оплаты домашних расходов.
Когда у нас появились дети, наши расходы увеличились, но мы также стали больше зарабатывать. Мы по-прежнему вели отдельные банковские счета, но каждый из нас отвечал за определенные расходы.
Эта специальная договоренность хорошо себя зарекомендовала, и в течение многих лет у нас не было официального бюджета. Однако по мере приближения к пенсии я понимаю, что у нас будет только около 50% нашего предпенсионного дохода. Поэтому пришло время серьезно взглянуть на то, как мы тратим наши деньги сейчас и как мы будем их тратить, когда у нас будет фиксированный доход.
Я могу списать часть наших расходов на дом, потому что я работаю из дома, так что я довольно хорошо справляюсь с этими расходами. Большинство других расходов, таких как еда, одежда, бензин, ремонт автомобилей, страхование, развлечения, путешествия, уход за домашними животными, подарки и т. Д., Списываются с кредитных карт, чтобы мы могли накапливать баллы авиакомпаний. Это займет некоторое время, но классифицировать и проанализировать эти расходы не составит большого труда.
Наконец, мы оба снимаем наличные через нерегулярные промежутки времени, чтобы заплатить за личный уход, обеды и другие разные расходы.Эти суммы труднее отслеживать, и нам придется составлять списки на наших смартфонах или находить подходящее приложение для смартфонов, чтобы систематизировать информацию.
Как только я пойму, что мы тратим сейчас по сравнению с тем, что у нас будет для жизни в будущем, я буду отслеживать наши ежемесячные расходы в сравнении с доходом и прогнозируемым доходом в таблице.
Некоторые из наших расходов сократятся после выхода на пенсию, потому что нам не нужно будет оплачивать профессиональные услуги, а мой муж не будет ездить на работу.Мы также будем платить более низкие налоги и больше не будем откладывать на пенсию. Сесть на одну машину или переехать в менее дорогой дом — более долгосрочные возможности. Но нет сомнений, что нам придется идти на компромиссы.
Независимо от того, только вы начинаете или приближаетесь к выходу на пенсию, вам может потребоваться помощь в составлении бюджета и его соблюдении. В канадском финансовом блоге Том Дрейк обсуждает, как выбрать платного финансового планировщика. Если вы погрязли в долгах, Общество кредитных консультаций Саскачевана может помочь вам консолидировать ваши долги, разработать бюджет и вернуться к правильному пути.
Если бы мы более тщательно составляли бюджет в течение последних 15-20 лет, у нас было бы больше средств на пенсию. Но вы можете начать прямо сейчас. Если вы использовали инструменты бюджетирования или ресурсы, которые вы рекомендуете другим, сообщите нам, и мы поделимся ими в следующей публикации.
для DJI Mavic Pro Drone передний / задний рычаг шасси для ремонта ног
| Состояние: | Новинка: Совершенно новый, неиспользованный, неоткрытый, неповрежденный предмет (включая предметы ручной работы).Увидеть продавца листинг для получения полной информации. Просмотреть все определения условий | Торговая марка: | Безымянный |
| Страна / регион производства: | Китай | Совместимый бренд: | Для DJI Mavic Pro |
| MPN: | Не применяется |
Для DJI Mavic Pro Drone Front / Rear Arm Landing Gear Leg Repair Car Parts
Для DJI Mavic Pro Drone Front / Rear Arm Landing Gear Leg Repair Car Parts
Игрушки и хоббиКупить для ваз 2109 онлайн
Отличная новость !!! Вы попали в нужное место для ваз 2109.К настоящему времени вы уже знаете, что все, что вы ищете, вы обязательно найдете на AliExpress. У нас буквально есть тысячи отличных продуктов во всех товарных категориях. Ищете ли вы товары высокого класса или дешевые и недорогие оптовые закупки, мы гарантируем, что он есть на AliExpress.
Вы найдете официальные магазины торговых марок наряду с небольшими независимыми продавцами со скидками, каждый из которых предлагает быструю доставку и надежные, а также удобные и безопасные способы оплаты, независимо от того, сколько вы решите потратить.
AliExpress никогда не уступит по выбору, качеству и цене. Каждый день вы найдете новые онлайн-предложения, скидки в магазинах и возможность сэкономить еще больше, собирая купоны. Но, возможно, вам придется действовать быстро, так как этот топ для ваз 2109 в кратчайшие сроки станет одним из самых востребованных бестселлеров. Подумайте, как вам будут завидовать друзья, когда вы им скажете, что купили свой для ВАЗ 2109 на AliExpress.Благодаря самым низким ценам в Интернете, дешевым тарифам на доставку и возможности получения на месте вы можете еще больше сэкономить.
Если вы все еще не уверены в ваз 2109 и думаете о выборе аналогичного товара, AliExpress — отличное место для сравнения цен и продавцов. Мы поможем вам решить, стоит ли доплачивать за высококлассную версию или вы получаете столь же выгодную сделку, приобретая более дешевую вещь.И, если вы просто хотите побаловать себя и потратиться на самую дорогую версию, AliExpress всегда позаботится о том, чтобы вы могли получить лучшую цену за свои деньги, даже сообщая вам, когда вам будет лучше дождаться начала рекламной акции. и ожидаемая экономия.AliExpress гордится тем, что у вас всегда есть осознанный выбор при покупке в одном из сотен магазинов и продавцов на нашей платформе. Реальные покупатели оценивают качество обслуживания, цену и качество каждого магазина и продавца.Кроме того, вы можете узнать рейтинги магазина или отдельных продавцов, а также сравнить цены, доставку и скидки на один и тот же продукт, прочитав комментарии и отзывы, оставленные пользователями. Каждая покупка имеет звездный рейтинг и часто имеет комментарии, оставленные предыдущими клиентами, описывающими их опыт транзакций, поэтому вы можете покупать с уверенностью каждый раз. Короче говоря, вам не нужно верить нам на слово — просто слушайте миллионы наших довольных клиентов.
И, если вы новичок на AliExpress, мы откроем вам секрет.Непосредственно перед тем, как вы нажмете «купить сейчас» в процессе транзакции, найдите время, чтобы проверить купоны — и вы сэкономите еще больше. Вы можете найти купоны магазина, купоны AliExpress или собирать купоны каждый день, играя в игры в приложении AliExpress. Вместе с бесплатной доставкой, которую предлагают большинство продавцов на нашем сайте, вы сможете приобрести vaz 2109 по самой выгодной цене.
Мы всегда в курсе последних технологий, новейших тенденций и самых обсуждаемых лейблов.На AliExpress отличное качество, цена и сервис всегда в стандартной комплектации. Начните самый лучший шоппинг прямо здесь.
ВАЗ-2114, КПП: устройство и ремонт
На автомобилях ВАЗ-2114 система трансмиссии достаточно простая. Серия «Лада-Самара» — это переднеприводные автомобили. Имеется сцепление ВАЗ-2114, коробка передач и механизм привода ведущих колес. Система сцепления понятна всем.Но не все разбираются в конструкции коробки передач. Давайте разберемся, что собой представляет КПП, какие бывают поломки, как ее обслуживать и ремонтировать.
Коробка передач ВАЗ-2114
Чтобы двигатель работал в оптимальных условиях при движении в различных условиях, автомобили комплектуются коробками передач. Этот механизм способен изменять величину крутящего момента, который передается от силового агрегата на ведущие колеса во время трогания с места или во время разгона.Механизм состоит из нескольких основных элементов. Это набор вращающихся валов и шестерен, звенья трансмиссии.
Корпус механизма включает в себя картер сцепления, картер коробки передач, заднюю крышку. Внутри механизма находится основная пара. Есть дифференциал и шестерни, за счет которых меняются передаточные числа. В этой машине использовался немного доработанный механизм, который остался с ВАЗ-2108. Разница в другой основной паре.
В коробке передач это главная передача или главный входной вал.Он предназначен для снижения оборотов двигателя. Главная передача позволяет уменьшить количество оборотов в соотношении 1 к 4. Таким образом, если количество оборотов двигателя составляет 2 тысячи, то частота вращения главной пары будет 500 об / мин.
На ВАЗ-2114 коробка передач в главной паре имеет штатный показатель — это 3,7. Этот показатель стабильный. Но если его поменять, можно скорректировать динамические характеристики автомобиля.
Максимальная скорость и разгонные возможности автомобиля зависят от размера главной пары.Именно этот элемент влияет на длину трансмиссии. Если поменять главную пару, можно отрегулировать длину всех шестерен. Также меняются ускорение и максимальная скорость.
На ВАЗ-2109 главная пара — 3,9. За счет этого максимальная скорость на этой машине ниже, но машина лучше разгоняется.
Коробка передач ВАЗ-2114 — пятиступенчатая механическая синхронизированная коробка передач. Главная передача связана с узлом дифференциала. Шестерни с первой по четвертую выполнены в виде блока и установлены на первичном валу коробки.Посажен пятый блок ведущих шестерен. На коробке передач ВАЗ-2114 также есть вторичный вал. На нем установлены ведомые шестерни. Сам вал соединен с ведущей шестерней через главную пару.
Передаточные числа
Вторая, не менее важная составляющая этой коробки — передаточные числа. Это шестерни, каждая из которых отвечает за определенную шестерню. Какие передаточные числа коробки передач у ВАЗ-2114? Ниже приводится характеристика каждой скорости:
- Первая передача — 3.636.
- Второй — 1,95.
- Третий — 1,357.
- Четвертый — 0,941.
- Пятая — 0,784.
- Передача заднего хода 3,53.
Стоит учесть, что штатная коробка передач далека от идеала. Первая передача слишком короткая, вторая очень длинная. Из-за этого у водителей может наблюдаться динамический сбой при резком переключении с первой передачи на вторую.
И даже больше — помимо отказа при резком переключении изнашиваются синхронизаторы.Посмотрите, как выглядит коробка передач на ВАЗ-2114 — фото есть в нашей статье.
Крылья
КПП также оборудован кулисой.
Это особый механизм, с помощью которого водитель переключается с одной передачи на другую. Дизайн кулисы разрабатывался еще в 80-х годах, поэтому у нее много разных недостатков. Большинство водителей ругали ее за неинформативность при переключении. Передачи не всегда включаются с первого раза. Связь застряла или коробка передач не подходит.
Скорость переключения зависит от длины детали. Например, у спорткаров укорачивают крылья. Это позволяет решить множество проблем переключения и добавляет динамики. В целях повышения информативности и управляемости крылья давно заменили тросиком. С ним КПП работает четче. Вы легко сможете включить необходимое снаряжение.
Привод управления коробкой передач также оснащен рычагом переключения передач, упором и шарикоподшипником, стержнем для выбора нужной передачи и механизмом выбора скорости.
Общие проблемы и их симптомы
Коробка передач ВАЗ-2114 производства АвтоВАЗа имеет достаточно высокий ресурс. Но иногда некоторые компоненты механизма могут выйти из строя. Рассмотрим типичные неисправности и их симптомы. Так же узнаем, как проводится ремонт.
Трансмиссия вылетает при включении и не фиксируется
Причина этой проблемы — изношенные зубья шестерен и сцепления. Это часто случается, если водитель пытается переключить передачи, не соблюдая ограничения скорости.Чтобы устранить эту неприятность, необходимо заменить поврежденные и изношенные детали. Если шестерни включаются независимо, то причина в износе, расслоении или трещинах резиновой части задней опоры.
Зубчатые колеса включены с усилием
В этом случае специалисты уверены, что расшатались зубья шарнирного крепления.
Также возможна деформация или повреждение от реактивной тяги. Это может быть связано с трещинами на пластиковых деталях в приводе коробки передач.
Нейтральный шум
Если на автомобиле ВАЗ-2114 коробка передач очень шумит на нейтральной передаче, это свидетельствует о низком уровне масла в коробке передач, а также о качестве залитого масла.Кроме того, подобный симптом наблюдается при сильном износе верхнего подшипника, который находится на первичном валу. Для устранения данной неисправности потребуется провести диагностику подшипника, а также долить масло до уровня.
Хруст и треск при переключении
При переключении водитель услышит хруст при износе синхронизаторов коробки передач.
Если вы пропустите начало этого процесса, то при дальнейшей эксплуатации потребуется замена не только поврежденного синхронизатора, но и зубчатого блока полностью.Если трещина слышен в момент переключения, то это указывает на износ блокирующего кольца одного из синхронизаторов или спутниковых осей. Срочно нужно поставить диагноз.
Шум передачи
Если коробка передач шумит во время движения, то причин может быть несколько. Эта проблема заключается в износе как верхнего, так и нижнего подшипников. Помимо шума возникают проблемы с заклиниванием рычага переключения передач. В этом случае необходима диагностика. При разборке КПП на ВАЗ-2114 блок предохранителей находится под капотом.Он находится в специальном блоке.
Хорошее масло — надежная работа коробки передач
Какой бы простой и неприхотливой ни была коробка передач на ВАЗ-2114, для нее нужно выбирать только качественное масло. Специалисты считают оптимальным вариантом трансмиссионные минеральные масла. Также можно использовать синтетические продукты. В случае использования синтетического масла необходима периодическая очистка сальников коробки передач. Для ящиков серии «Самара-2» подходят средства категории ГЛ-4. Чтобы работа трансмиссии была максимально надежной и безаварийной, необходимо постоянно проверять уровень масла.
Самый простой способ — использовать стилус.
Заключение
Коробка передач — сложный механизм, требующий правильного ухода.
