38. Влияние катализатора на скорость химических реакций. Причины влияния катализатора.
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Катализаторы, уменьшающие скорость реакции, называются ингибиторами. Влияние, оказываемое катализаторами на химические реакции, называется катализом. Сущность катализа заключается в том, что в присутствии катализатора изменяется путь, по которому проходит суммарная реакция, образуются другие переходные состояния с иными энергиями активации, а поэтому изменяется и скорость химической реакции. Различают гомогенный и гетерогенный катализ. При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины и свойств его поверхности. Для того чтобы иметь большую поверхность, катализатор должен обладать пористой структурой или находиться в сильно раздробленном состоянии. Катализаторы отличаются селективностью: они действуют на процессы избирательно, направляя его в определенную сторону. Отрицательный катализ используется для замедления коррозии.
39. Обратимые процессы. Химическое равновесие. Константа равновесия.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. 2KClO 3 = 2KCl + 3O 2 ↑. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. 3H2 + N2 ⇆ 2NH3
Обратимые реакции
протекают не до конца: ни одно из
реагирующих веществ не расходуется
полностью. Обратимые процессы: вначале,
при смешении исходных веществ, скорость
прямой реакции велика, а скорость
обратной равна нулю. По мере протекания
реакции исходные вещества расходуются
и их концентрации падают, в результате
чего уменьшается скорость реакции.
Одновременно появляются продукты
реакции, чья концентрация растет, и,
соответственно, растет скорость обратной
реакции. Когда скорости прямой и обратной
реакции становятся одинаковыми,
наступает химическое равновесие. Его
называют динамическим равновесием,
так как прямая и обратная реакции
протекают, но из-за одинаковых скоростей,
изменений в системе не заметно.
Количественной характеристикой
химического равновесия служит величина,
называемая константой химического
равновесия. При равновесии скорости
прямой и обратной реакции равны, при
этом в системе устанавливаются постоянные
концентрации исходных веществ и
продуктов реакции, называемые равновесными
концентрациями. Для 2CO + O 2 = 2CO2 константа равновесия может быть
рассчитана по уравнению: 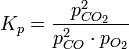 Численное значение константы равновесия
в первом приближении характеризует
выход данной реакции. Выходом реакции
называется отношение количества
получаемого вещества к тому его
количеству, которое получилось бы при
протекании реакции до конца. K>>1
выход реакции велик, K<10-6). В случае
гетерогенных реакций в выражение
константы равновесия входят концентрации
только тех веществ, которые находятся
в наиболее подвижной фазе. Катализатор
не влияет на константу равновесия. Он
может только ускорить наступление
равновесия. K=e^(-ΔG/RT).
Численное значение константы равновесия
в первом приближении характеризует
выход данной реакции. Выходом реакции
называется отношение количества
получаемого вещества к тому его
количеству, которое получилось бы при
протекании реакции до конца. K>>1
выход реакции велик, K<10-6). В случае
гетерогенных реакций в выражение
константы равновесия входят концентрации
только тех веществ, которые находятся
в наиболее подвижной фазе. Катализатор
не влияет на константу равновесия. Он
может только ускорить наступление
равновесия. K=e^(-ΔG/RT).
40. Влияние различных факторов на смещение равновесия. Принцип Ле- Шателье.
Если система находится в равновесии, то она будет пребывать в нем до тех пор, пока внешние условия сохраняются постоянными. Процесс изменения каких-либо условий, влияющих на равновесие, называется смещением равновесия.
Принцип Ле: Если на сист. наход. в равновесии оказать внешнее воздействие, то система измен. таким образом, чтобы компенсировать это воздействие.
Следствия: 1) При увеличении температ. равновесие смещ. в пользу эндотермической реакции.
2) При увеличении давления равновесие смещ. в сторону меньшего объёма(или меньш. числа молей)
3) При увеличении концентрации одного из исходных веществ равновесие смещается в сторону увеличения концентрации продуктов реакции, и наоборот.
Влияние катализатора на скорость химических реакций
Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами.
Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называются каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации резко понижается: некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Для ряда реакций промежуточные соединения изучены; как правило, они представляют собою весьма активные нестойкие продукты.
Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. Катализ можно представить следующим образом:
А + К = А*
А* + В = С + D + К,
где А* — промежуточное активированное соединение.
В химической промышленности катализаторы применяются весьма широко. Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
Различают гомогенный и гетерогенный катализ.
В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
Примеры гомогенного катализа:
1. окисление SO2 + 1/2O2 = SO3 в присутствии NO. NO легко окисляется до NO2, а NO2 уже окисляет SO2;
2. разложение пероксида водорода в водном растворе на воду и кислород. Ионы Сг2О2=7, WO2-4, МоО2-4, катализирующие разложение пероксида водорода, образуют с ним промежуточные соединения, которые далее распадаются с выделением кислорода.
Гомогенный катализ осуществляется через промежуточные реакции с катализатором и в результате происходит замена одной реакции с высокой энергией активации, несколькими, у которых энергии активации ниже, скорость их выше:
CO + 1/2O2 = CO2 (катализатор — пары воды)
Широкое применение в химической промышленности находит гетерогенный катализ. Большая часть продукции, вырабатываемой в настоящее время этой промышленностью, получается с помощью гетерогенного катализа. При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины и свойств его поверхности. Для того чтобы иметь большую («развитую») поверхность, катализатор должен обладать пористой структурой или находиться в сильно раздробленном (высокодисперсном) состоянии. При практическом применении катализатор обычно наносят на носитель, имеющий пористую структуру (пемза, асбест и др.).
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через активные промежуточные соединения. Но здесь эти соединения представляют собой поверхностные соединения катализатора с реагирующими веществами. Проходя через ряд стадий, в которых участвуют эти промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор в результате не расходуется.
Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции.
Каталитическое действие поверхности сводится к двум факторам: увеличение концентрации на границе раздела и активирование адсорбированных молекул.
Примеры гетерогенного катализа:
2H2O = 2H2O + O2 (катализатор – MnO2,)
Н2 + 1/2 О2 = Н2О (катализатор — платина)
Очень большую роль играет катализ в биологических системах. Большинство химических реакций, протекающих в пищеварительной системе, в крови и в клетках животных и человека, являются каталитическими .реакциями. Катализаторы, называемые в этом случае ферментами, представляют собою простые или сложные белки. Так, слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар. Фермент, имеющийся в желудке, — пепсин — катализирует расщепление белков. В организме человека находится около 30 000 различных ферментов: каждый из них служит эффективным катализатором соответствующей реакции.
Селективность действия катализатора – продукты реакции могут быть разными в зависимости от того, каким катализатором мы пользуемся.
Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление «отрицательного катализа»).
Влияние катализаторов на скорость химических реакций
Катализаторами называют вещества, способные ускорять химическую реакцию, при этом сами катализаторы в химической реакции не расходуются. Установлено, что катализаторы изменяют механизм химической реакции. При этом возникают другие, новые переходные состояния, характеризуемые меньшей высотой энергетического барьера. Таким образом, под действием катализатора снижается
10
энергия активации процесса (рис.3). Вступая в различного рода взаимодействия с промежуточными частицами, катализаторы по окончании реакции остаются в неизменном количестве. Катализаторы оказывают действие только на термодинамически разрешенные реакции. Катализатор не может вызвать реакцию, т.к. не влияет на ее движущие силы. Катализатор не влияет на константу химического равновесия, т.к. в равной степени уменьшает энергию активации и прямой, и обратной реакций.

11
Различают гомогенный и гетерогенный катализ. В первом случае катализатор находится в одной фазе с реагентами, а во втором — катализатором является твердое вещество, на поверхности которого идет химическая реакция между реагентами.
Химическое равновесие
Химические реакции принято подразделять на обратимые и необратимые. Необратимые химические реакции протекают до полного расходования хотя бы одного из исходных веществ, т.е. продукты реакции или совсем не вступают во взаимодействие друг с другом, или образуют вещества, отличные от исходных. Таких реакций очень мало. Например:
2KСlO3(тв) = 2KCl(тв) + 3О2(г)
В растворах электролитов практически необратимыми считаются реакции, идущие с образованием осадков, газов и слабых электролитов (вода, комплексные соединения).
Большинство химических реакций являются обратимыми, т.е. они идут как в прямом, так и в обратном направлении. Это становится возможным, когда энергии активации прямого и обратного процессов отличаются друг от друга незначительно, а продукты реакции способны превращаться в исходные вещества. Например, реакция синтеза HIявляется типично обратимой реакцией:
H2(г)+I2(г) ⇄ 2HI(г)
Закон
действующих масс (выражение скорости
реакции) для прямого и обратного
процессов соответственно будет иметь
вид:  =
= [H2] ∙ [I2];
[H2] ∙ [I2]; 
 =
=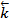 [HI]2
[HI]2
В
какой-то момент времени наступает
состояние, когда скорости прямой и
обратной реакций становятся равными  =
=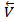 (рис.4).
(рис.4).
12

Рис.4Изменение скоростей
прямой ( и
обратной (
и
обратной ( реакций
с течением времени t
реакций
с течением времени t
Это состояние называется химическим равновесием. Оно носит динамический (подвижный) характер и может сдвигаться в ту или другую сторону в зависимости от изменения внешних условий. Начиная с момента равновесия, при неизменных внешних условиях концентрации исходных веществ и продуктов реакции не изменяются с течением времени. Концентрации реагентов, отвечающие состоянию равновесия, называются равновесными. Для определения равновесной концентрации реагента необходимо из его начальной концентрации вычесть количество вещества, прореагировавшего к моменту наступления равновесного состояния:Сравн. = Сисх. – Спрореагир. Количество реагентов, вступивших в реакцию и образовавшихся из них к моменту равновесия продуктов, пропорциональны стехиометрическим коэффициентам в уравнении реакции.
Состояние равновесия при неизменных внешних условиях может существовать сколь угодно долго. В состоянии равновесия
 [H2] ∙ [I2]=
[H2] ∙ [I2]= [[HI]2,
откуда
[[HI]2,
откуда /
/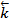 [=
[HI]2/[H2]
∙ [I2] .
[=
[HI]2/[H2]
∙ [I2] .
При постоянной температуре константы скоростей прямого и обратного процесса являются величинами постоянными.
13
Отношение
двух констант является также величиной
постоянной K= /
/ и носит названиеконстанта химического
равновесия. Она может быть выражена
и носит названиеконстанта химического
равновесия. Она может быть выражена
либо
через концентрации реагентов  =
= ,
либо через их парциальные давления
,
либо через их парциальные давления
 ,если
реакция протекает с участием газов.
,если
реакция протекает с участием газов.
В общем случае для реакции aA+bB+ …⇄cC+dD+ …константа химического равновесия равна отношению произведения концентраций продуктов реакции к произведению концентраций исходных веществ в степенях, равных их стехиометрическим коэффициентам.
 =
=
Константа химического равновесия не зависит от пути протекания процесса и определяет глубину его протекания к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Константа химического равновесия, также как и константы скоростей реакций, являются функциями только температуры и природы реагирующих веществ и не зависят от их концентрации.
Для гетерогенных процессов концентрация твердых веществ в выражение скорости реакции и константы химического равновесия не включается, т.к. реакция протекает на поверхности твердой фазы, концентрация которой остается во времени постоянной. Например, для реакции:
FeO(тв)+CO(г)⇄ Fe(тв)+CO2(г)
выражение константы равновесия будет иметь вид:
 =
=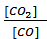 ,
,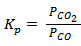
14
Кри Кс связаны соотношениемKp = Kc(RT)∆n, гдеn=nпрод.-nисх.веществ– изменение числа молейгазообразныхвеществ в ходе реакции. Для данной реакции Кр= Кс, т.к.nгазообразных веществ равно нулю.
Влияние катализатора на мощность двигателя

Автомобильный нейтрализатор выполняет важные функции – снижение токсичности выхлопных газов и предупреждение выброса в атмосферу вредных компонентов, негативно влияющих на здоровье человека. Однако неопытные автовладельцы считают, что эти детали способны нанести вред другим элементам транспортного средства, в частности, мотору. Чтобы узнать о влиянии катализатора на мощность двигателя, стоит детально разобраться в устройстве запчасти.
Катализатор портит двигатель – правда или миф
Поскольку автокатализатор фильтрует выхлопные газы, он не разрушает, а наоборот, позволяет всем основным элементам транспортного средства работать эффективнее. Единственные ситуации, когда устройство может принести вред мотору – эксплуатация неисправной детали или несоблюдение рекомендаций по использованию. В этом случае изделие влияет на авто следующим образом:
- При применении некачественного, этилированного топлива, соты катализатора плавятся и разрушаются. Такой бензин негативно воздействует и на другие части автомобиля.
- Поврежденный нейтрализатор перестает эффективно очищать выхлопы, в результате чего токсичные газы проникают к остальным составляющим выхлопной системы и затрудняют их работу.
- Если автонейтрализатор не заменять или полностью избавиться от запчасти, произойдет сбой в системе управления – потребуется прошивка электронного блока.
- Забитый сажей, испорченный, оплавленный катализатор с поврежденными сотами действительно влияет на эффективность двигателя. Если выхлопные газы задерживаются в системе, мощность мотора снижается. Поскольку водителю постоянно приходится давить на педаль газа, также увеличивается расход топлива, что приводит к дополнительным затратам.
Кроме того, автомобиль, в котором установлена вышедшая из строя запчасть, загрязняет окружающую среду, поскольку вместо безвредных водяного пара, азота и углерода, в атмосферу выбрасываются отравляющие соединения. Поэтому задача каждого ответственного водителя – своевременно заменять катализаторы.
Признаки неисправности катализатора
Подумать о замене автомобильного катализатора следует, если:
- Машина начала без видимых причин потреблять больше топлива.
- Чтобы набрать оптимальную скорость, приходится регулярно жать на педаль газа, вдавливая ее в пол.
- Неприятный запах выхлопов ощущается даже в салоне авто.
- Количество выхлопных газов увеличилось.
- При разгоне слышны постукивания, ощущаются вибрации.
- Автомобиль стал регулярно глохнуть.
Утилизация отработанного катализатора в пункт приема позволит сэкономить на покупке новой запчасти. Мы принимаем изделия, независимо от вида, количества и уровня износа, предлагая достойную оплату. Благодаря использованию современного оборудования для оценки металлов, гарантируем честный результат и оперативный расчет.
Понравилась информация? Поделись с друзьями
НОУ «Влияние природы катализатора на скорость химических реакций»
Муниципальное бюджетное образовательное учреждение
средняя общеобразовательная школа №37
Научное общество учащихся
Влияние природы катализатора на разложение перекиси водорода
Выполнил: Дерябин Максим Сергеевич
9в класс МБОУ СОШ №37
Научный руководитель:
Незговорова Марина Вячеславовна
учитель химии I категории
Нижний Новгород
2015 год
Содержание
Введение…………………………………………………………..стр. 3-4
Глава 1. Теоретическая часть
История открытия явления катализа……………………… стр.4-5
Скорость химических реакций ……………………………. стр.5
Факторы, влияющие на скорость химической реакции … .стр.6
Катализаторы ……………………………………………….. стр.6-7
Виды катализаторов ……………………………………….. стр.7-8
Механизм действия катализаторов…………………………стр.8-9
1.7Разложение перекиси водорода ………………………………стр.9-10
3. Глава 2. Практическая часть.
2.1. Опыты с оксидами марганца (II) и железа (II)……………..стр.10-12
Опыты с ферментами…………………………………… стр.12
Опыты с раствором перманганата калия……………… ..стр.12-14
4. Заключение………………………………………………………..стр.15-16
5. Список источников и литературы……………………………….стр.17
6. Приложение 1……………………………………………………..стр.18
Приложение 2……………………………………………………..стр.19
Введение
Химические реакции протекают с различными скоростями. Химические реакции могут проходить быстро, медленно или мгновенно. Скорость химической реакции зависит от многих факторов, а предсказанием скорости химической реакции и выяснением зависимости скорости химической реакции от условий проведения процесса занимается химическая кинетика. Химическая кинетика — наука о закономерностях протекания химических реакций во времени. Скорость химической реакции зависит от концентрации реагирующих веществ, природы реагирующих веществ, наличия катализатора, температуры, давления, площади поверхности соприкосновения реагирующих веществ и природы катализатора.
Чтобы не прибегать к значительному повышению температуры и давления, часто используют катализаторы, которые могут быть очень эффективными в зависимости от их природы, концентрации катализатора, среды (кислотной, щелочной, нейтральной), площади поверхности катализатора. Катализаторы широко применяют в промышленности, технике, нефтепереработке, нефтехимии, производстве серной кислоты, аммиака, азотной кислоты. Большинство реакций, протекающих в живых организмах, также являются каталитическими. Примером эффективного применения катализатора является производство в современных условиях аммиака под действием пористого железа с примесями Al2O3 и K2O. Производство аммиака при помощи катализатора позволило значительно понизить производственные затраты на поддержание во время реакции высоких температуры и давления. Но, помимо технических катализаторов, существуют природные катализаторы, их называют ферментами. Ферменты более активные катализаторы по сравнению с техническими катализаторами. Они представляют собой крупные белковые молекулы живых организмов, их функция — ускорение процесса обмена веществ в организме.
Целью нашей работы является исследование влияния различных катализаторов на скорость химической реакции (на примере каталитического разложения перекиси водорода).
Для этого были поставлены следующие задачи:
1) изучить литературный материал о влиянии катализаторов на скорость химической реакции;
2) исследовать зависимость скорости химической реакции от природы катализатора, концентрации катализатора, площади поверхности катализатора, среды (кислотной, щелочной и нейтральной).
3) провести опыты, позволяющие сравнить эффективность различных катализаторов относительно друг друга.
Глава 1.
1.1. История открытия явления катализа
Катализ – изменение скорости химической реакции в присутствии катализаторов. Самые простые научные сведения о катализе были известны уже к началу XIX в. Знаменитый русский химик, академик К.С.Кирхгоф, открыл в 1811 году каталитическое превращение крахмала в сахар под действием разбавленных кислот. Эта реакция лежит в основе крахмалопаточного производства. А в 1814 году он открыл фермент – амилазу, и им же было установлено, что эту реакцию может катализировать диастаза из ячменного солода, чем было положено начало изучению биологических катализаторов – ферментов. Четыре года спустя Г.Деви открыл способность паров спирта и эфира окисляться кислородом на платине. В 1822 году И.Деберейнер установил, что при обычной температуре можно соединять водород и кислород на платине. Вскоре эти и многие другие открытия привели к установлению существования явлений, в 1833 г. названных Э. Митчерлихом контактными, а в 1835 г. И. Берцелиусом – каталитическими. В органической химии успехи катализа связаны с развитием теории строения органических соединений А.М.Бутлерова. Большую роль сыграли каталитические методы в развитии процессов органического синтеза.
Следующим направлением использования катализатора является каталитическая очистка технологических газов, а также очистка сточных вод, загрязненных органическими веществами. В живой природе вся система управления жизненными процессами в организмах основана на катализе. Такие процессы, как брожение, дыхание, пищеварение, синтез белков и других соединений и т. п. осуществляется с помощью ферментов, называемых энзимами.
1.2. Скорость химической реакции.
В химической кинетике для определения скорости химической реакции обычно принято рассматривать превращение исходных веществ, количество которых в ходе эксперимента уменьшается. Для описания этого процесса во времени требуется введение понятия скорости превращения.
Если химические реакции происходят в одной среде, например в растворе или в газовой фазе, то взаимодействие реагирующих веществ происходит во всём объёме. Такие реакции называются гомогенными. Скорость гомогенной реакции определяется как изменение концентрации одного из исходных веществ в единицу времени. Если реакция идёт между веществами, находящимися в разных агрегатных состояниях или между веществами, неспособными образовывать гомогенную среду, то она проходит только на поверхности соприкосновения веществ. Такие реакции называют гетерогенными. Формула нахождения скорости реакции при гомогенном катализе:
υ гом =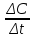 =
=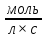
где ∆C — изменение концентрации исходных веществ (моль/л),
∆t — промежуток времени (с).
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единицу поверхности. Химическая реакция может протекать только при непосредственном контакте реагирующих частиц. Формула нахождения скорости реакции при гетерогенном катализе:
υ гет =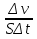 =
=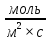
где ∆ν — количество вещества (моль),
S-площадь поверхности (м2) , ∆t — промежуток времени (с).
1.3. Факторы, влияющие на скорость химической реакции.
Скорость химической реакции зависит от многих факторов. Основными из них являются: природа и концентрация реагирующих веществ, давление (в реакциях с участием газов), температура, действие катализаторов и поверхность реагирующих веществ в случае гетерогенных реакций. Т.к скорость химической реакции зависит от площади соприкосновения реагирующих веществ, их измельчают. Наибольшей степени измельчения достигают путем растворения веществ. Быстрее всего вещества реагируют в растворах.
Можно увеличить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют её по энергетически более выгодному пути с меньшей энергией активации. Их называют катализаторами.
1.4. Катализаторы.
Катализаторы — это вещества, участвующие в химической реакции и изменяющие её скорость или направление, но по окончании реакции остающиеся неизменными качественно и количественно.
Каждая химическая реакция между одинаковыми или различными веществами начинается, естественно, со столкновения двух частиц. Минимальный избыток энергии, который должна иметь частица или пара частиц, чтобы произошло эффективное соударение, называют энергией активации Ea (где под эффективным соударением понимается соударение частиц, приводящее к химическому взаимодействию).
Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных (не противоречащих термодинамическим законам) направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий. Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — каталитические, это связанно с тем, что применять при производстве катализаторы более доступно и дёшево, чем повышать температуру и давление. С ростом температуры скорость реакции обычно увеличивается и часто довольно заметно. За счет чего это происходит? Это может быть связано с увеличением концентрации реагирующих веществ или константы скорости (константа скорости численно равна «скорости реакции при «концентрации каждого из реагирующих веществ равной 1 C»моль/л). Концентрация в газовой смеси при постоянном объеме не зависит от изменения температуры (т.к. при изменении температуры и давления объём газа меняется соответственно), а в растворах почти не зависит от температуры (объем раствора остается почти постоянным). Т.е. заметно может увеличиваться только константа скорости реакции. В самом начале кинетических исследований было отмечено, что скорость (или, очевидно, константа скорости) увеличивается с ростом температуры не линейно, т.е. если построить график зависимости константы скорости от времени, то график будет иметь вид кривой, а не прямой. Поскольку химическое взаимодействие происходит при соударениях частиц, то рост константы может быть связан с увеличением числа соударений с ростом температуры за счет увеличения скорости движения частиц.
1.5. Виды катализаторов.
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды. Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот, применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами — это CaO, BaO, MgO. Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность с множеством пор, которые являются активными центрами для адсорбции (адсорбция — увеличение %86″концентрации растворенного вещества у поверхности раздела двух «фаз вследствие нескомпенсированности сил межмолекулярного взаимодействия этом разделе) жидкости к поверхности катализатора, для чего катализаторы распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.). Инертные носители предназначены для увеличения площади контактирующей поверхности катализатора, что ускорит химическую реакцию, т.к. один из факторов, оказывающих влияние на скорость химической реакции — площадь контактирующей поверхности катализатора. В биохимических реакциях роль катализаторов играют ферменты. Химические реакции, протекающие при участии катализаторов, называют каталитическими. Не все реакции нуждаются в катализаторах, но многие без катализаторов практически идти не могут. Примеры таких реакций:
2H2O2 = 2Н2O+O2.
С2Н5ОН → Н2О + С2Н4.
СО + Н2 → СН3ОН.
высоких температурах 420-650o C , в присутствие катализатора ( платины-Pt, оксида ванадия(V)-V2O5, железа-Fe ) :
2SO2 + O2 = 2SO3.
1.6. Механизм действия катализаторов.
Известно, что в ходе любой каталитической реакции катализаторы остаются неизменными качественно и количественно, так как же работают катализаторы ? Катализаторы изменяют механизм реакции на энергетически более выгодный, то есть снижают энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий:
Диффузия реагирующих веществ к поверхности твердого вещества(диффузия-взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц вещества)
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их(хемосорбция- поглощение вещества поверхностью какого либо тела )
Химическая реакция между реагирующими молекулами
Десорбция продуктов с поверхности катализатора(десорбция- удаление из жидкостей или твердых тел веществ, поглощенных при адсорбции)
Диффузия продукта с поверхности катализатора в общий поток
1.7. Разложение перекиси водорода.
Разложение Н2О2 и его растворов, в том числе и взрывное, вызывают многие вещества. Взрывы Н2О2 объясняются сильной экзотермичностью реакции, цепным характером процесса (это означает, что количества теплоты, которое выделяется в ходе реакции достаточно для взрыва перекиси водорода) и значительным снижением энергии активации разложения Н2О2 в присутствии различных веществ: ионы I–, платина, ионы Fe2+, каталаза. Фермент каталаза содержится в крови, именно благодаря ей «вскипает» от выделения кислорода аптечная «перекись водорода», когда ее используют для дезинфекции порезанного пальца. Ферменты, влияющие на реакции пероксида водорода, играют большую роль в жизнедеятельности клетки. Энергию организму поставляют реакции окисления с участием поступающего из легких кислорода. В этих реакциях промежуточно образуется Н2О2, который вреден для клетки, так как вызывает необратимое повреждение различных биомолекул. Каталаза и пероксидаза совместно превращают Н2О2 в воду и кислород. Реакции разложения Н2О2 идут в присутствии различных металлов переменной валентности. Связанные в комплексные соединения, они часто значительно усиливают свою активность (под комплексными соединениями подразумевается химическое вещество, в состав которого входят комплексные частицы). Комплексная частица – сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Например, ионы меди менее активны, чем ионы железа, но связанные в аммиачные комплексы [Cu(NH3)4]2+, они вызывают быстрое разложение Н2О2. Аналогичное действие оказывают ионы Mn2+, связанные в комплексы с некоторыми органическими соединениями. Активными катализаторами для разложения пероксида водорода являются коллоидные растворы (ультрамикрогетерогенные дисперсные системы, размер частиц которых лежит в пределе от 1 до 100 нм) палладия, платины, иридия, золота, серебра, а также твердые оксиды некоторых металлов – MnO2, Co2O3, PbO2 и др., которые сами при этом не изменяются.
Глава 2. Практическая часть.
2.1. Опыты с оксидами.
2.1.1. Опыты с оксидом марганца (II).
Мы приготовили 0,3% р-р перекиси водорода (перекись водорода — бесцветная жидкость, не имеющая запаха). Для этого мы разбавили 3% р-р перекиси водорода: в мерный цилиндр мы налили 90 мл дистиллированной воды, а затем долили туда 10 мл неразбавленной перекиси. Далее мы перелили получившийся р-р в коническую колбу со шлейфом. По мере того, как перекись в ходе опытов расходовалась, мы приготавливали р-р снова. Используя рычажные весы, мы взвесили 0,1г MnO2 (MnO2 — чёрный тяжёлый порошок). Далее мы собрали установку, как показано на рис.1. Мы налили перекись водорода на дно пробирки, добавили туда катализатор и мгновенно закрыли пробирку пробкой. Как только в перевёрнутой вверх дном пробирке появился первый пузырик кислорода, начался отсчет времени и измерение объёма выделившегося кислорода. Реакция в присутствии MnO2 прошла очень быстро.
Рис 1.

2.1.2. Опыты с оксидом марганца (II) и оксидом железа (III).
Используя приготовленный р-р перекиси, мы провели аналогичный первому опыт, но кроме 0,1г MnO2 , мы также добавили 0,1г Fe2O3 (приготовили порошкообразную смесь из двух оксидов). Опыт показал, что оксид железа (III) (Fe2O3 — бурый тяжёлый порошок) не обладает свойствами катализатора (т.к реакция пошла с такой же скоростью, как и в первом опыте).
2.1.3. Опыты с оксидом марганца (II) и оксидом меди (II).
Добавив к оксиду марганца (II) массой 0,1г, оксид меди (II) (CuO — чёрный порошок) массой 0,1г, высыпав смесь в пробирку с перекисью (сразу же закрыв пробирку пробкой), и сделав необходимые замеры с помощью секундомера и делений на перевёрнутой пробирке, можно увидеть, что в присутствии смеси из MnO2 и CuO реакция идёт медленнее, чем в присутствии одного оксида марганца (II).
2.1.4. Опыты с оксидом хрома (III).
Использовав оксид хрома (III) (Cr2O3 — лёгкий зелёный порошок), массой 0,1г для разложения перекиси водорода, мы увидели, что оксид хрома (III) является слабым катализатором.
2.2. Опыты с ферментами.
2.2.1. Опыты с крупными кусочками моркови.
Мы нарезали ножом морковь на крупные кусочки, с помощью пинцета мы бросили кусочки в пробирку с перекисью, сразу же закрыв её пробкой. Масса моркови 5г. Из опыта видно, что реакция идёт не быстро, но равномерно.
2.2.2. Опыты с мелко натёртой морковью.
Мы мелко натёрли морковь на тёрке, с помощью пинцета мы бросили морковь в пробирку с перекисью, сразу же закрыв её пробкой. Масса моркови 5г. Из опыта видно, что реакция идёт быстрее, чем с крупными кусочками моркови.
2.2.3. Опыты с мелко натёртым картофелем.
Мы мелко натёрли картофель, после чего с помощью пинцета мы бросили картофель в пробирку с перекисью, сразу же закрыв её пробкой. Масса картофеля 5г. Из опыта видно, что реакция идёт быстрее, чем в опытах с морковью.
2.2.4. Опыты с мясным фаршем.
Мы пропустили мясо через мясорубку, получив мясной фарш. Далее, с помощью пинцета, мы бросили фарш в пробирку с перекисью, сразу же закрыв её пробкой. Масса фарша 5г. Из опыта видно, что реакция идёт немного медленнее, чем в опытах с морковью.
2.3. Опыты с раствором KMnO4.
2.3.1. В нейтральной среде.
Мы приготовили 10% р-р KMnO4 (ярко-малиновый р-р сухого марганцовокислого калия), используя сухой KMnO4 (марганцовокислый калий — тёмно-фиолетовые кристаллы) и воду. Затем с помощью пипетки мы вылили в пробирку 1мл р-ра KMnO4 . Потом, используя мерный цилиндр, мы налили в пробирку 20 мл перекиси водорода концентрацией 0,3%, после чего сразу же закрыли пробирку пробкой. Во всех дальнейших опытах концентрация р-ра марганцовокислого калия оставалась неизменной. Реакция прошла медленно, но равномерно.
2.3.2. В кислой и щелочной средах.
2.3.2.1. В кислотной среде.
Мы взяли уксусную кислоту Ch4COOH (уксусная кислота — бесцветная жидкость с характерным резким запахом) концентрацией 10%, обьёмом 0,1мл, и с помощью пипетки налили её в пробирку. Затем мы, используя пипетку, налили в пробирку р-р марганцовокислого калия. Потом мы вылили в пробирку перекись водорода, после чего сразу закрыли пробирку пробкой. Из опыта видно, что реакция идёт очень бурно, значительно быстрее, чем в опыте с нейтральной средой.
2.3.2.2. В щелочной среде.
Мы приготовили 10% р-р щёлочи NaOH (раствор гидроксид натрия -бесцветная жидкость). Взяли раствор объёмом 0,1мл, вылили р-р в пробирку, используя пипетку, после чего налили в пробирку р-р марганцовокислого калия, также используя пипетку. Затем вылили в пробирку перекись, после чего сразу же закрыли её пробкой. Реакция прошла быстрее, чем в опыте с нейтральной средой, но медленнее чем в опыте с кислотной средой.
2.3.3. Опыты с различными объемами раствора KMnO4.
2.3.3.1. Объем раствора KMnO4 0,5мл.
Мы взяли 10% р-р KMnO4. Используя пипетку, мы вылили в пробирку 0,5мл марганцовокислого калия, затем мы долили в пробирку перекись, после чего сразу же закрыли пробирку пробкой. Реакция прошла со средней скоростью.
2.3.3.2. Объем раствора KMnO4 1мл.
Мы взяли 10% р-р KMnO4. Затем с помощью пипетки мы вылили в пробирку 1мл р-ра KMnO4 , после чего мы налили в пробирку перекись и сразу же закрыли пробирку пробкой. Реакция прошла медленней, чем в опыте с концентрацией KMnO4 0,5мл.
2.3.3.3. Объем раствора KMnO4 2мл.
Мы взяли 10% р-р KMnO4. Затем с помощью пипетки мы вылили в пробирку 2мл р-ра KMnO4 , после чего мы налили в пробирку перекись и сразу же закрыли пробирку пробкой. Реакция прошла очень медленно (медленней, чем в опытах с объемом KMnO4 равным 0,5мл и 1мл).
2.3.3.4. Объем раствора KMnO4 3мл.
Мы взяли 10% р-р KMnO4. Затем с помощью пипетки мы вылили в пробирку 3мл р-ра KMnO4 , после чего мы налили в пробирку перекись и сразу же закрыли пробирку пробкой. Реакция прошла со средней скоростью, немного медленнее, чем в опыте с концентрацией KMnO4 равной 1мл.
Заключение
В данной работе были проведены опыты с различными катализаторами реакции разложения пероксида водорода, включая ферменты, оксиды металлов, растворы солей. Были проведены опыты, показывающие, как скорость химической реакции зависит от различных факторов: среды, площади поверхности катализатора, объема раствора катализатора. Был также проведён ряд опытов с оксидами, показывающий, какие оксиды являются наиболее эффективными катализаторами.
Наилучшим образом в качестве катализатора разложения пероксида водорода проявил себя среди оксидов металлов оксид марганца (IV) . Из графика 1 видно, что скорость реакции разложения в этом случае максимальная. По сравнению с прочими использованными в качестве катализаторов веществами среди оксидов металлов катализирует реакцию разложения пероксида водорода слабо оксид хрома (III). Из графика 1 можно увидеть, что скорость реакции разложения в этом случае минимальная. Среди всех, тестируемых нами оксидов металлов, оксид меди (II) не является катализатором, что видно из графика 1.
Среди природных катализаторов наибольшую эффективность показала мелко-натёртая морковь, о чём можно судить по графику 2. В этом случае скорость реакции не является максимальной, но продолжительность катализа здесь выше, по сравнению с мелко-натёртым картофелем. В присутствие мелко-натёртого картофеля скорость реакции разложения перекиси водорода является максимальной среди ферментов, что видно из графика 2. Наименьшая скорость реакции в опытах с ферментами наблюдается под действием крупных кусочков моркови, что видно из графика 2.
Среды опытов с раствором перманганата калия, в различных средах наибольшая скорость реакции наблюдалась в опыте с уксусной кислотой, что видно из графика 3. Наименьшая скорость реакции среди опытов с раствором перманганата калия, в различных средах была в опыте с нейтральной средой , что можно увидеть из графика 3.
В опытах с различными объёмами раствора марганцовокислого калия, наибольшая скорость реакции наблюдалась в опыте с объёмом раствора марганцовокислого калия 0,5мл, что можно увидеть из графика 4. Наименьшая скорость реакции была зафиксирована в опыте с объёмом раствора марганцовокислого калия 2мл, что можно наблюдать из графика 4.
Проблему поиска эффективных катализаторов для различных реакций с целью их промышленного применения можно пытаться решить через экспериментальную проверку каталитического эффекта различных веществ, в различных концентрациях, средах и т.д.
Список источников и литературы
1 .Кубасов А.А. Химическая кинетика и катализ. –М.:МГУ,2005. -155 с.
2. Нарышкин Д.Г. Кинетика химических реакций.- М.:Издательский дом МЭИ, 2009. — 190 с.
3. Семиохин И.А.,Страхов Б.В., Осипов А.И. Кинетика химических реакций.-М.:Издательство Московского университета,1986. -232 с.
4. Семиохин И.А.Физическая химия.-М.:МГУ,2001. -272 с.
5. Семишин В.И.Практикум по общей химии.-М-Л.:Госхимздат,1954.-338 с.
Интернет сайты
6. http://knowledge.allbest.ru/
7. ru.wikipedia.org
Приложение 1.
График 1.
График 2
Приложение 2.
График 3.
График 4.
Влияние катализатора на скорость реакции — Мегаобучалка
Катализ–явление изменения скорости реакций в присутствии веществ – катализаторов, которые вступают в промежуточное взаимодействие с реагирующими веществами, но не входят в состав продуктов реакции.
Катализаторы, увеличивающие скорость реакции, называются положительными, а уменьшающие – отрицательными. Отрицательные катализаторы называются ингибиторами.
Механизм действия катализатора сводится к изменению энергии активации данной реакции: положительные катализаторы уменьшают энергию активации и тем самым увеличивают число активных молекул, а отрицательные – увеличивают энергию активации, тем самым уменьшая число активных молекул. Это происходит за счет образования промежуточных, нестойких комплексов, которые в дальнейшем распадаются на продукты реакции с выделением катализатора в химически неизменном виде.
В отсутствие катализатора реакцию можно представить следующим образом:
А + В = АВ
В присутствии катализатора реакция протекает в две быстро идущие стадии:
1 стадия А + Каt = АКаt
2 стадия AKat + B = AB + Kat ,
в результате которых сначала образуются частицы промежуточного соединения AKat, а затем конечные продукты с регенерацией катализатора.
Если катализатор и реагирующие вещества находятся в одной фазе, то процесс называют гомогенным катализом.
Гетерогенный катализ протекает на границе раздела фаз, катализатор в гетерогенном катализе, как правило, находится в твердой фазе. Процесс в этом случае начинается с адсорбции исходных молекул на поверхности катализатора. Образование промежуточных соединений происходит на активных центрах катализатора. Активные центры составляют незначительную долю всей поверхности. Для увеличения поверхности катализатора и, тем самым, увеличения числа его активных центров его тонко измельчают.
Свойства катализатора:
1. Катализатор не входит в состав исходных веществ и продуктов реакции, поэтому не может оказать влияние на изменение энергии Гиббса DG, следовательно, он не может вызвать протекание реакций, для которых DG>0. Катализатор ускоряет те реакции, для которых DG<0.
2. Для обратимой реакции катализатор не смещает химическое равновесие и не влияет на константу равновесия, а лишь ускоряет достижение химического равновесия.
3. Использование катализатора не влияет на тепловой эффект химической реакции, так как тепловой эффект реакции не зависит от пути процесса.
4. Из возможных параллельных реакций катализатор ускоряет только одну – селективное действие катализатора.
5. Подбор катализатора проводится экспериментально. Для гетерогенного катализа часто используются переходные металлы и их соединения, при этом особенно высоким каталитическим действием отличаются металлы VIII Б подгруппы.
6. Активность и селективность катализатора можно изменить, вводя в объем твердого тела или на поверхность катализатора вещества, не обладающие каталитической активностью, но повышающие активность катализатора – промоторы. Вещества, которые приводят к уменьшению активности катализатора, называются каталитическими ядами.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Написать математическое выражение закона действия масс для гомогенной реакции :
2NO(г) + O2(г) = 2NO2(г)
Решение. В связи с тем, что перед NO стоит коэффициент 2, а перед O2 стоит коэффициент 1 в законе действия масс стоит концентрация NO в квадрате, а концентрация O2 в первой степени:
Пример 2. Написать математическое выражение закона действия масс для гетерогенной реакции:
2C(к) + O2(г) = 2CO(г)
Решение. Твердая фаза в явном виде не входит в закон действия масс, поэтому для данной реакции:
Пример 3. Во сколько раз изменится скорость реакции
2NO(г) + O2(г) = 2NO2(г)
при увеличении концентрации NO в 3 раза?
Решение. Первоначальная скорость реакции может быть записана следующим образом:
после повышения концентрации NO в 3 раза
Таким образом, скорость реакции увеличилась в 9 раз.
Пример 4. Во сколько раз изменится скорость реакции
2NO(г) + O2(г) = 2NO2(г)
при увеличении объема системы в 3 раза?
Решение. Увеличение объема в системе равносильно уменьшению давлению: во сколько раз увеличивается объем, во столько же раз уменьшается давление, поэтому задачу можно переформулировать: во сколько раз изменится скорость реакции при уменьшении давления в системе в 3 раза? Для расчета следует использовать уравнение закона действия масс, в котором скорость выражена через парциальные давления, т.е:
При уменьшении общего давления в системе парциальные давления всех компонентов уменьшаются в такое же число раз:
Таким образом, скорость реакции уменьшилась в 27 раз.
Пример 5. Вычислить, во сколько раз увеличится скорость реакции при увеличении температуры на 30оС, если температурный коэффициент равен 2.
Решение. По правилу Вант-Гоффа
Пример 6. Определить температурный коэффициент γ для реакции, скорость которой увеличилась в 32 раза при увеличении температуры на 50 К.
Решение. Подставим условие в правило Вант-Гоффа: . Получится . Теперь надо представить 32 как число, возведенное в степень 5, т.е. 32=25. Следовательно, 25=γ5. Отсюда γ=2.
Пример 7.Скорость реакции 2СO(г) + O2(г) = 2СО2(г) при концентрациях равна 0,72. Вычислить константу скорости реакции.
Решение. Запишем закон действия масс для данной реакции
выразим из него константу скорости .
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. В чем разница между гомогенными и гетерогенными реакциями?
2. Какие факторы влияют на скорость химических реакций?
3. Как формулируется закон действия масс? Каков физический смысл константы скорости реакции?
4. Как влияет температура на скорость химических реакций?
5. Сформулируйте правило Вант-Гоффа.
6. Напишите математическое выражение закона действия масс для реакции
4Al(к) + 3O2(г) = 2Al2O3(к)
7. Во сколько раз изменится скорость реакции
N2(г) + 3H2(г) = 2NH3(г)
при уменьшении объема системы в 3 раза?
8. Во сколько раз изменится скорость реакции
2Fe2O3(к) + 3CO(г) = 4Fe(к) + 3CO2(г)
при увеличении концентрации CO в 3 раза?
9. Вычислите, во сколько раз увеличится скорость реакции при увеличении температуры на 50оС, если температурный коэффициент равен 3.
10.Определите температурный коэффициент γ для реакции, скорость которой уменьшилась в 32 раза при понижении температуры с 70ºС до 20ºС.
11. Скорость реакции 2NO(г) + O2(г) = 2NO2(г)
при равна 0,054. Константа скорости реакции равна 0,012. Вычислите .
Влияние катализатора — Справочник химика 21
Катализ. Основные понятия. Катализом называют явление иэменения скорости реакции или возбуждения ее, происходящее под действием некоторых веществ, называемых катализаторами, которые, участвуя в процессе, сами к концу реакций остаются химически неизменными. Как известно, влияние катализаторов может быть весьма сильным и под их действием скорости реакций могут изменяться в миллионы и большее число раз как в ту, так и в другую сторону. Под действием катализаторов могут [c.491]Влияние катализатора на снижение энергии активации процесса можно проиллюстрировать следующими данными для реакции распада иодида водорода [c.205]
Температура. Согласно классическим представлениям, если исключить влияние катализаторов, скорость химических реакций является функцией температуры и концентрации реагирующих веществ. По известному правилу Вант-Гоффа, повышение температуры на 10 градусов ускоряет реакцию в 2—3 раза. Это правило не является строгим, так как температурный коэффициент скорости реакции меняется с температурой. К. И. Ивановым [35 было показано, что температурный коэффициент окисления углеводородов, равный 2, наблюдается только для 140—150 °С. При температурах ниже 140 °С он во всех случаях гораздо больше, а выше 150°С он меньше. [c.69]
В сложных полиэфирах происходит межцепной обмен по обоим механизмам между карбоксильной (или гидроксильной) и сложноэфирной группами, а также между сложноэфирными» группами макромолекул. Эти реакции осуществляются, как правило, под влиянием катализаторов и при повышенной температуре. [c.160]
Применение методов прикладной статистики в задачах анализа и прогнозирования свойств катализатора требует корректного учета специфики решаемых задач и возникающих ограничений. Так, в гетерогенном катализе широко распространено явление взаимного влияния катализатора и реакционной среды. Примером такой ситуации может служить гетерогенное окисление бензола и ксилола на ванадиевых катализаторах, когда вследствие разности в восстановительных потенциалах обоих углеводородов меняется стационарный состав катализатора по слою. В работе (291 показано, что дегидратация алифатических спиртов на оксидных катализаторах (оксидах А1, Хг, 31) хорошо описывается уравнением Тафта с литературными значениями а. Однако коэффициент чувствительности а изменяется от оксида к оксиду. Следовательно, мы приходим к необходимости учитывать опосредованное влияние других переменных. Это обстоятельство делает необходимым использовать такие измерители статистической связи, которые были бы очищены от подобного влияния [21. [c.68]
Другие наблюдаемые явления, нанример, изомеризация с образованием разветвленных цепей, получение ароматических углеводородов и др., вызваны вторичными реакциями, которые связаны с действием катализаторов на олефины [247, 249—251]. При 500° С парафины от Сд до а также твердый парафин (приблизительно С24) расщепляются в присутствии циркониево-алюмосиликатного катализатора в 5—60 раз быстрее, чем без катализатора при той же температуре. Хотя пропан, н-бутан и изобутан крекируются над катализатором несколько быстрее, чем термически, влияние катализатора проявляется достаточно сильно лишь в том случае, когда сырьем служат парафины g и выше. [c.327]
Сложившееся противоречие можно проиллюстрировать на примере полибутадиенов различного строения. Рассмотрим цис-иош-бутадиен, полученный под влиянием катализатора Циглера — Натта, этот полимер имеет наиболее совершенную микроструктуру среди каучуков данного типа. Практически приемлемым в про мышленности оказался каучук, имеющий индекс полидисперсно- [c.92]
При полимеризации бутадиена под влиянием катализаторов на основе я-аллильных комплексов никеля, получаются полимеры со сложным молекулярным составом, содержащие линейные и разветвленные макромолекулы, а также полимерные частицы (микрогель), образование которых связано с некоторой гетерогенностью применяемого комплексного катализатора. [c.60]В рамках рассматриваемой схемы важно установить роль катализаторов. Окисление сероводорода диоксидом серы носит кислотноосновной характер. Этот факт можно объяснить следующим образом [83]. Взаимодействие и 50, в водных растворах протекает с высокими скоростями. Согласно схеме Абеля, образуется неустойчивая тиосернистая кислота Н,5,0,, которая распадается на поли-тионаты и тиосульфат. Последние продукты оказываются довольно стабильными в интервале рН=3…7 и медленно распадаются с образованием серы. Как показано выше, для ускорения этого процесса необходимо присутствие катализаторов. Проце