Катализатор — Википедия
Схема протекания реакции с катализаторомКатализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Противоположное понятие — ингибитор.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют
системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
См. также
Примечания
- ↑ 1 2 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ 1 2 Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано 25 августа 2011 года.
Ссылки
Катализатор Адкинса — Википедия
Материал из Википедии — свободной энциклопедии
Катализатор Адкинса — это хромит меди, комплексное неорганическое соединение состава Cu2Cr2O5, которое используется для катализа в органическом синтезе. Зачастую содержит оксид бария. Впервые был описан в 1908 г. [1]
Примеры применения в органическом синтезе[править | править код]
- Восстановление альдегидов и кетонов до соответствующих спиртов. Например, восстановление продукта, полученного ацилоиновой конденсацией себациновой кислоты, с помощью этого катализатора приводит к 1,2-циклодекандиолу. [3]
- Восстановление 2-фуриловых спиртов до 1,5-пентадиолов при 250-300°C и давлении водорода 23-41 МПа. [4]
- Декарбоксилирование α-фенилкоричной кислоты до цис-стильбена. [5]
Восстановление водородом протекает при относительно высоком давлении (около 135 атм.) и температуре (150-300°C) и носит название «гидрирующей бомбы». Более активные катализаторы, требующие менее жестких условий, как правило основаны на использовании дорогих металлов, таких как платина.
- ↑ Gröger, M. “Über Ammoniumdoppelchromate” Zeitschrift fur anorganische Chemie volume 58, page 412-426 (1908). (недоступная ссылка)
- ↑ Lazier, W. A.; H. R. Arnold, H. “Copper Chromite Catalyst” Organic Syntheses, Collected Volume 2, p. 142 (1943). Архивная копия от 9 октября 2010 на Wayback Machine
- ↑ Blomquist, A. T.; Goldstein, A. «1,2-Cyclodecanediol» Organic Syntheses Collected Volume 4, p.216. Архивная копия от 9 октября 2010 на Wayback Machine
- ↑ Kaufman, D.; Reeve, W. “1,5-Pentanediol” Organic Syntheses, Collected Volume 3, p.693 (1955). Архивная копия от 9 октября 2010 на Wayback Machine
- ↑ Buckles, R. E.; Wheeler, N. C. “cis-Stilbene” Organic Syntheses, Collected Volume 4, p.857 (1963). (недоступная ссылка)
Катализатор Линдлара — Википедия
Материал из Википедии — свободной энциклопедии
 Состав катализатора Линдлара
Состав катализатора ЛиндлараКатализатор Линдлара — гетерогенный катализатор гидрирования, который применяется для селективного восстановления алкинов до (Z)-алкенов (без дальнейшего восстановления до алканов), а также для восстановления азидов и нитросоединений до аминов. Представляет собой палладий, нанесённый на карбонат кальция и отравленный какой-либо солью свинца или серой[1].
Катализатор Линдлара представляет собой тёмно-серый или чёрный порошок, содержащий 5 % палладия. Нерастворим в большинстве органических растворителей, несовместим с водой и кислотами[1].
Основной сферой применения катализатора Линдлара является селективное восстановление алкинов до (Z)-алкенов. Обычно гидрирование в таких случаях резко останавливается после поглощения алкином одного эквивалента водорода. Терминальные алкины восстанавливаются быстрее внутренних, а алкены медленнее алкинов. Сопряжённые енины восстанавливаются до сопряжённых диенов с отличной селективностью. Также хорошо восстанавливались тройные связи, сопряжённые с одной или двумя карбонильными группами
[1].Редким применением катализатора Линдлара являются реакции окисления. Так, метакролеин был окислен в его присутствии до метилметакрилата с высокой селективностью и конверсией[1].
Катализатор можно хранить в закрытой таре вдали от растворителей и отравляющих веществ (содержащих серу и фосфор). В присутствии растворителей катализатор Линдлара становится пирофорным. Суспендировать его в реакционной смеси нужно в инертной атмосфере, а при фильтрации не допускать полного высыхания осадка[1].
Носитель катализатора — Википедия
Материал из Википедии — свободной энциклопедии
Носитель катализатора
Роль носителя в гетерогенном катализе состоит в предотвращении агломерации или спекания активного компонента, что позволяет поддерживать высокую площадь контакта активного вещества (см. активная каталитическая фаза) и реагентов. Количество носителя, как правило, гораздо больше количества нанесенного на него активного компонента. Основными требованиями к носителям являются большая площадь поверхности и пористость, термическая стабильность, химическая инертность, высокая механическая прочность. В ряде случаев носитель влияет на свойства активной фазы (эффект «сильного взаимодействия металл–носитель»). В качестве носителей применяют как природные (глины, пемза, диатомит, асбест и др.), так и синтетические материалы (активные угли, силикагель, алюмосиликаты, оксиды алюминия, магния, циркония и др.).
- Chorkendorff I., Niemantsverdriet J.W. Concept of Modern Catalysis and Kinetics. — Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2003. — 452 p.
- Крылов О. В. Гетерогенный катализ. — М.: ИКЦ «Академкнига», 2004. — 679 с.
Катализатор — Википедија
Катализатор е секоја супстанција во хемијата која ги забрзува хемиските реакции, без притоа нејзиното количество при реакцијата да се измени. Хемиските реакции во кој учествува одреден катализатор се наречени реакции на катализа. Во случаи на хомогена катализа, катализаторот стапува во реакција со еден од реактантите (т.е. супстратот) и со него образува меѓупродукт. Дури потоа меѓупродуктот стапува во заемно дејство со другите реактанти за на крајот да се образуваат продукти. При хетерогена катализа, пак, честички од реактантите се апсорбираат на површината на катализаторот, а потоа таму се случува елементарен акт на хемиска трансформација.
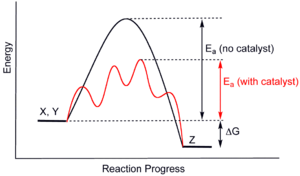 Дијаграм на генерирана потенцијална енергија која што го покажува влијанието на катализаторот врз хипотетички екзотермната реакција
Дијаграм на генерирана потенцијална енергија која што го покажува влијанието на катализаторот врз хипотетички екзотермната реакцијаРеакција без катализатор: A + B --> AB Реакција со катализатор: A + B + K --> [ABK] [ABK] --> AB + K
Забрзувањето на хемиските реакции со присуство на катализатори е многу корисно, а каталитичките реакции наоѓаат широка примена. Практична важност имаат т.н. каталитички конвертори што се поставуваат на патот на издувните гасови кај автомобилите. Други, доста важни катализатори се биокатализаторите, наречени ензими, кои ги катализираат биохемиските реакции.
 | Оваа статија за од областа на хемијата е никулец. Можете да помогнете со тоа што ќе ја проширите.
|
|
Каталитические яды — Википедия
Материал из Википедии — свободной энциклопедии
Каталитические яды, или контактные яды — вещества, вызывающие «отравление» катализатора, то есть снижающие его каталитическую активность или полностью прекращающие каталитическое действие.
Причина отравления заключается в адсорбции каталитического яда на поверхности катализатора. Различают следующие виды каталитического отравления:
— Каталитический яд может адсорбироваться на активном центре катализатора, препятствуя взаимодействию реагентов с этим активным центром. В данном случае наблюдается линейная зависимость снижения каталитической активности от количества введенного в систему яда.
Пример: действие хинолина на алюмосиликатные катализаторы при крекинге.
— Экранирование — яд может сильно отравить поверхность катализатора, что приведет к резкому снижению каталитической активности. В этом случае введение дополнительных доз яда будет снижать активность медленно.
Пример: разложение пероксида водорода на платиновом катализаторе при адсорбции яда — дихлорида ртути.
Случается, что в микродозах некоторый каталитический яд может служить и промотором, когда в больших количествах начинает действовать как яд. Данный вид действия принято называть модифицированием катализатора. В случае сложных каталитических реакций каталитические яды могут действовать избирательно — подавлять каталитическую активность в одних катализаторах и не влиять на другие. В некоторых случаях одни и те же вещества могут быть каталитическими ядами по отношению к одним реакциям и не влиять на другие.
К числу наиболее распространенных каталитических ядов принадлежат Н2О, СО, СО2, H2S, N, P, As, Sb и др.
Каталитические яды // Краткая химическая энциклопедия / Кнунянц И. Л.(гл. редактор) — М: Советская Энциклопедия, 1961—1967 гг. Т.2, С.488
Каталитический крекинг — Википедия
Каталитический крекинг — термокаталитическая переработка нефтяных фракций с целью получения компонента высокооктанового бензина, легкого газойля и непредельных жирных газов.
Каталитический крекинг — один из важнейших процессов, обеспечивающих глубокую переработку нефти. Внедрению каталитического крекинга в промышленность в конце 30-х гг. 20 в. (США) способствовало создание эффективного с большим сроком службы катализатора на основе алюмосиликатов (Э. Гудри, 1936 г). Основное достоинство процесса — большая эксплуатационная гибкость: возможность перерабатывать различные нефтяные фракции с получением высокооктанового бензина и газа, богатого пропиленом, изобутаном и бутенами; сравнительная легкость совмещения с другими процессами, например, с алкилированием, гидрокрекингом, гидроочисткой, адсорбционной очисткой, деасфальтизацией и т. д. Такой универсальностью объясняется весьма значительная доля каталитического крекинга в общем объёме переработки нефти.
В настоящее время сырьем каталитического крекинга служит вакуумный газойль — прямогонная фракция с пределами выкипания 350—500°С. Конец кипения определяется, в основном, содержанием металлов и коксуемостью сырья, которая не должна превышать 0,3 %. Фракция подвергается предварительной гидроочистке для удаления сернистых соединений и снижения коксуемости. Также у ряда компаний (UOP, IFP) имеется ряд разработанных процессов каталитического крекинга тяжелых фракций — например, мазута (с коксуемостью до 6-8 %). Так же в качестве сырья используют остаток гидрокрекинга, в качестве компонентов сырья возможно использование деасфальтизатов, петролатумов, фильтратов обезсмасливания гачей.
Кратность циркуляции катализатора к сырью — 10:1 (для установок с лифт-реактором), Температура — 510—540 °C, Давление — 0,5-2 атм
Температура — 650—730 °C, Давление — 1-3 атм
На установках прошлого поколения использовался аморфный шариковый катализатор. Представляет собой шарики 3-5 мм с площадью поверхности 200 м²/гр.
В настоящее время используется цеолитсодержащий микросферический катализатор (размер частиц 35-150 мкм). Площадь поверхности 300-400 м²/гр. Он представляет собой крекирующий цеолитный компонент, нанесенный на аморфную алюмосиликатную матрицу. Содержание цеолита не превышает 30%. В качестве цеолитного компонента используется ультрастабильный цеолит Y, иногда с добавками цеолита ZSM-5 для увеличения выхода и октанового числа бензина. Ряд компаний при приготовлении катализатора также вводят в цеолит редкоземельные металлы. В катализаторе крекинга также содержатся добавки, уменьшающие истирание катализатора, а также промоторы дожига СО, образующегося в регенераторе при выжиге кокса, до СО2.
Различают установки по организации процесса:
- Периодические (реакторы Гудри). Через нагретый стационарный слой катализатора пропускают сырье и, после того как он закоксуется, реактор ставят на регенерацию;
- Непрерывной регенерации. Из реактора выводится закоксованный катализатор, с поверхности которого выжигается кокс в отдельном аппарате и возвращается в реактор. После регенерации катализатор сильно нагрет, чего хватает для процесса крекинга, поэтому процесс каталитического крекинга не нуждается в подводе внешнего тепла.
Установки непрерывной регенерации подразделяются:
- Реакторы с движущимся слоем катализатора. Слой шарикового катализатора движется сверху вниз по реактору навстречу поднимающимся парам сырья. При контакте происходит крекинг, катализатор через низ отправляется на регенерацию, продукты на разделение. Регенерация протекает в отдельном аппарате с помощью воздуха; при этом выделяющееся при сгорании кокса тепло используют для генерации пара. Типовая установка — 43-102.
- Реакторы с кипящим слоем катализатора. Микросферический катализатор витает в потоке паров сырья. По мере закоксовывания частицы катализатора тяжелеют и падают вниз. Далее катализатор выводится на регенерацию, которая проходит также в кипящем слое, а продукты идут на разделение. Типовые установки — 1-А/1М, 43-103.
- Реакторы с лифт-реактором. Нагретое сырье в специальном узле ввода диспергируется и смешивается с восходящим потоком катализатора в специальном узле. Далее смесь катализатора и продуктов крекинга разделяется в кипящем слое сепаратора специальной конструкции. Остатки продуктов десорбируются паром в десорбере. Время контакта сырья и катализатора составляет несколько секунд. Типовая установка — Г-43-107.
- Миллисеконд. Характерная особенность процесса — отсутствие лифт-реактора. Катализатор поступает в реактор нисходящим потоком, в катализатор перпендикулярно направлению его движения впрыскиваются пары сырья. Общее время реакции составляет несколько миллисекунд, что позволяет (повысив соотношение катализатор:сырье) добиться повышения выхода бензиновой фракции вплоть до 60-65%
На данный момент наиболее совершенными являются лифт-реакторы. Выход бензина на них составляет 50-55% с октановым числом 91-92,5 , тогда как у реакторов с кипящим слоем выход бензина 49-52% с октановым числом 90/92,5.
Типичный материальный баланс процесса каталитического крекинга гидроочищенного вакуумного газойля
| Продукция | Выход % на сырье |
|---|---|
| Взято всего: | 100 |
| Гидроочищенный вакуумный газойль (Фр.350-500°С) | 100 |
| Получено всего: | 100 |
| H2 | 0,04 |
| СН4 | 0,25 |
| C2H6 | 0,23 |
| C2H4 | 0,36 |
| C3H8 | 0,85 |
| С3H6 | 2,73 |
| бутан | 0,89 |
| бутены | 2,5 |
| изобутан | 4,20 |
| бензиновая фракция (ОЧИ-91/92) | 58,62 |
| газойль (легкий+тяжелый) | 27,17 |
| Кокс + потери | 2,17 |
Газ каталитического крекинга наполовину состоит из непредельных углеводородов, в основном, пропилена и бутенов. Также присутствуют значительные количества изобутана. Благодаря этому бутан-бутиленовая фракция газа используется как сырье процесса алкилирования с целью получения высокооктанового бензина. Пропан-пропиленовая фракция используется для выделения пропилена для производства полипропилена. Ввиду большой суммарной мощности установок каталитического крекинга, доля пропилена, вырабатываемого в процессе, составляет до 15% от его общего производства. Сухой газ (водород, метан, этан) используется в качестве топлива в печах заводских установок.
В процессе каталитического крекинга вырабатывается высокооктановый бензин с ОЧИ 88-91 пунктов. Кроме того, бензин содержит менее 1% бензола и 20-25% ароматических углеводородов, что дает возможность использовать его для приготовления бензинов согласно последним нормам Евросоюза (Евро-4, Евро-5). Основной недостаток бензина каталитического крекинга — высокое содержание непредельных углеводородов (до 30%) и серы (0,1-0,5%), что очень плохо влияет на стабильность топлива при хранении. Бензин быстро желтеет из-за полимеризации и окисления олефинов и потому не может применяться без смешения с другими бензиновыми фракциями.
- Легкий газойль
Легким газойлем каталитического крекинга считается фракция 200-270°С (реже 200-320 или 200-350). В ней содержится большое количество ароматических углеводородов, что приводит к низкому цетановому числу ( как правило, не выше 20-25). Кроме того, даже при условии предварительной гидроочистки сырья, в легком газойле содержится значительное количество сернистых соединений (0,1-0,5%). Из-за этого легкий газойль не может использоваться в больших количествах для приготовления дизельного топлива. Рекомендуемое его содержание в дизельном топливе — до 20% (в случае, если в топливе имеется запас по содержанию серы и цетановому числу). Другое применение легкого газойля — снижение вязкости котельных топлив, судовое топливо и производство сажи.
- Тяжелый газойль
Тяжелый газойль каталитического крекинга — это фракция, начинающая кипеть выше 270°С (реже 320,350). Из-за большого содержания полициклических ароматических углеводородов эта фракция (при определенном содержании серы) является прекрасным сырьем процесса коксования с получением высококачественного игольчатого кокса. При невозможности утилизировать фракцию этим путём, её используют как компонент котельного топлива.
- Крекинг нефтяных фракций на цеолитсодержащих катализаторах. Под. ред. С. Н. Хаджиева. — М., Химия, 1982.
- Смидович Е. В. Технология переработки нефти и газа. Крекинг нефтяного сырья и переработка углеводородных газов. Ч. 2. — М., Химия, 1980.
- Капустин В. М., Кукес С. Г., Бертолусини Р. Г. Нефтеперерабатывающая промышленность США и бывшего СССР. — М., Химия, 1995.