какой уровень электролита должен быть в АКБ, как проверить, нужно ли добавлять дистиллят
Какое количество жидкости добавить?
Количество добавляемой в аккумулятор воды зависит от того, насколько низок уровень внутри банок.
Иногда, достаточно влить 50 мл для восстановления работоспособности батареи.
Если дистиллированная вода не заливалась в течение года и более, то в результате содержимое может практически полностью испариться.
В каждой банке нового аккумулятора находится в среднем около 700 мл дистиллята. При испарении воды объём может уменьшиться незначительно (при регулярном обслуживании), поэтому если снижение уровня произошло не в результате опрокидывания батареи, то для восстановления работоспособности АКБ достаточно будет приобрести литровую ёмкость с дистиллированной водой.
Внимание! Только химически чистая вода может быть использована для доливки в аккумуляторную батарею.
Последствия несоблюдения пропорций
При несоблюдении пропорций аккумулятор не будет способен накопить необходимое количество электрического тока.
Если эксплуатация батареи с низким уровнем дистиллированной воды осуществляется длительное время, то химический источник тока может выйти из строя по причине чрезмерного окисления внутренних пластин аккумуляторной батареи.
Этот процесс наблюдается в том случае, если полностью оголяются свинцовые решётки, которые взаимодействуют с воздухом. В свою очередь, образовавшая диэлектрическая плёнка препятствует нормальному прохождению тока.
Последствия перелива
При переливе способность аккумулятора накапливать электроэнергию резко снижается.
Более высокий уровень может вызвать и другие нежелательные последствия во время эксплуатации аккумулятора.
Если банки наполнены «под завязку», то, при использовании батареи на автомобиле, будет наблюдаться разбрызгивание содержимого во время движения машины по ухабистой дороге. Постоянный контакт металла кузова с водой и электролитом приведёт к появлению ржавчины и сквозной коррозии.
Также по этой причине могут окисляться клеммы аккумулятора. Наличие слоя диэлектрика на проводах и контактах может вызвать серьёзные отклонения в работе электрической системы автомобиля.
Наличие слоя диэлектрика на проводах и контактах может вызвать серьёзные отклонения в работе электрической системы автомобиля.
Внимание! Если аккумулятор эксплуатируется стационарно, то выделение воды при переливе банок также возможно. Во время зарядки батареи повышенными токами, в том числе при длительном подключении ЗУ при рекомендованном уровне заряда, содержимое способно «закипать».
Это явление представляет собой активное перемещение внутри электролита пузырьков газа. Разбрызгивание кислоты также способно привести к порче различных металлических предметов, а также вызвать размножение бактерий и грибков по причине наличия высокой влажности в помещении.
Вред недолива
Недостаточное количество дистиллята в банках аккумулятора может привести к полному выходу источника электроэнергии из строя. Неопытные автолюбители очень часто пренебрегают регулярными осмотрами АКБ с обязательной проверкой банок.
По этой причине, особенно в летнее время, автомобиль просто может не завестись. Если машина эксплуатируется в нежарком климате, то уменьшение уровня дистиллята может происходить очень медленно.
Если машина эксплуатируется в нежарком климате, то уменьшение уровня дистиллята может происходить очень медленно.
Постепенное снижение количества смеси в банках вызывает ускорение процесса сульфатации пластин.
Окисление свинцовой решётки является одной из главных причин снижения срока эксплуатации аккумулятора.
Недолив дистиллированной воды одинаково негативно отразится на работоспособности перезаряжаемого источника электроэнергии вне зависимости от того, на машине используется изделие или стационарно.
Внимание! Если за АКБ не следить, то восстановить источник тока после сильной сульфатации добавлением дистиллированной воды, будет уже невозможно.
Факторы, влияющие на объем дистиллята
При эксплуатации аккумуляторов, в которых используется внутри банок дистиллированная вода, необходимо знать о причинах снижения уровня. Наиболее часто такой патологический процесс наблюдается:
- При высокой температуре воздуха.

- При чрезмерном нагреве АКБ в результате зарядки или разрядки большими токами.
- Разгерметизации корпуса.
- При движении автомобиля по ухабистой дороге.
- В результате чрезмерного углового наклона машины.
В незначительной степени на уровень дистиллированной воды также могут оказывать влияние атмосферное давление и влажность воздуха.
Какой уровень должен быть в АКБ?
В аккумуляторе на 55 А/ч оптимальное количество содержимого — около 2,5 литров.
В каждую банку АКБ заливается равное количество дистиллированной воды.
Если эксплуатируется аккумуляторная батарея на 12 Вольт, то для получения необходимого напряжения АКБ будет состоять из 6 последовательно соединённых банок. Соответственно на каждую ячейку будет приходиться по 416 мл.
Как выполнить проверку?
Проверить количество жидкости в аккумуляторе можно визуально. Многие модели АКБ изготавливаются из полупрозрачного пластика. На внешней боковой поверхности таких изделий часто делаются риски Min и Max.
Справка! Если уровень дистиллированной воды находится в промежутке между обозначениями Min и Max, то аккумулятор можно использовать по назначению без каких-либо ограничений.
Если батарея изготовлена из прочного материала значительной толщины, то в таких изделиях для производители устанавливают внутри банок пластмассовые элементы, которые свисают с крышки изделия. При достижении этих «маяков» уровень будет считаться оптимальным.
Для проверки уровня дистиллированной воды можно воспользоваться пластиковой палочкой, которую следует опустить в отверстие банки и коснуться ею пластин. Затем необходимо замерить намоченную смесью часть этого «индикатора». Нормальным уровнем электролита над свинцовыми решётками можно считать значение в 15 – 18 мм.
Провести замеры можно и с помощью прозрачной стеклянной или пластмассовой трубки. Такое изделие необходимо опустить в банку до упора в верхнюю часть свинцовых решёток.
Затем следует закрыть пальцем отверстие и поднять трубку. В результате таких действий в полом изделии окажется определённое количество воды. По высоте столбика можно судить об уровне дистиллята.
В результате таких действий в полом изделии окажется определённое количество воды. По высоте столбика можно судить об уровне дистиллята.
Что делать, если перелил?
Во время добавления дистиллята в банки можно случайно превысить максимальный уровень.
Учитывая возможные негативные последствия, перелив необходимо обязательно устранить.
Выполняется эта операция очень просто:
- С помощью резиновой груши или ареометра удаляются излишки (рекомендуется понизить уровень ниже нормы).
- Добавить небольшое количество дистиллята (до оптимального уровня).
В процессе корректировки уровня электролита в банках методом добавления дистиллированной воды, рекомендуется контролировать плотность ареометром.
Внимание! Категорически запрещается уменьшать уровень дистиллированной воды в аккумуляторе методом опрокидывания изделия на бок. В результате таких действий может произойти короткое замыкание в свинцовых пластинах.
Видео по теме
В дополнение к сказанному выше вы можете посмотреть это видео:
Заключение
Доливать дистиллированную воду в обслуживаемый аккумулятор необходимо регулярно. Даже если батарея эксплуатируется в оптимальном режиме, расход воды будет наблюдаться даже в процессе заряда и отдачи накопленной электроэнергии.
полная замена, доливка в необслуживаемый аккумулятор, когда доливать воду
Иногда при осмотре аккумулятора при вывернутых пробках можно увидеть на блоках пластин с сепараторами серый или коричневатый налет. Это признак того, что требуется замена электролита в аккумуляторе. Мельчайшие продукты разрушения свинцовых решеток хорошо видны в конце процесса заряжания аккумулятора, когда жидкость начинает кипеть и при этом происходит интенсивное ее перемешивание. Остальные проблемы с электролитом (снижение плотности, уменьшение уровня), устраняются добавлением дистиллированной воды или раствора серной кислоты плотностью 1,29 г/см³.
Остальные проблемы с электролитом (снижение плотности, уменьшение уровня), устраняются добавлением дистиллированной воды или раствора серной кислоты плотностью 1,29 г/см³.
В каких случаях доливать электролит в аккумулятор
На увеличение срока надежной работы АКБ оказывает влияние не столько качество ее обслуживания, сколько нагрузки, какие испытывает батарея. От чрезмерных разрядов происходит выкипание жидкости через отверстия в пробках.
Такое часто случается зимой, когда двигатель автомобиля запускается не сразу и неопытный водитель долго (более 10 секунд без перерыва) держит стартер включенным. Нагрузка на батарею резко возрастает, электролит закипает и происходит его выброс.
Такая же ситуация возникает, если водитель забыл заправить автомобиль бензином, при неисправностях в системах зажигания и питания двигателя. В этом случае добавляем раствор такой же плотности, как и в АКБ. Уровень проверяем визуально, слой электролита над блоком пластин с сепараторами должен быть не менее 5-7 мм.
Уровень проверяем визуально, слой электролита над блоком пластин с сепараторами должен быть не менее 5-7 мм.
Как приготовить электролит для аккумулятора
В магазинах и сервисных центрах продается уже готовый раствор серной кислоты, который и называется электролитом. Плотность его 1,29 г/см3. Работать с ним безопаснее, тут не действует правило «кислота льется в воду», как для растворов концентрацией свыше 40%. Поэтому в домашних условиях достаточными мерами предосторожности будут проведение работ на открытом воздухе или в помещении на сквозняке, в резиновых перчатках. По возможности нужно надевать очки.
Плотность должна соответствовать температурным особенностям региона и времени года. Летом снижают концентрацию раствора на 0,02 г/см³ от рекомендуемого зимой.
В приготовленную стеклянную или полиэтиленовую бутылку наливают требуемый объем электролита. Если плотность его больше, чем требуется, небольшими порциями дистиллированной воды доводят раствор до нужной концентрации. После каждой доливки делают замеры ареометром. Разбавляют до тех пор, пока показания прибора не будут превышать требуемые на 0,01 г/см³, т. к. перемешивание происходит постепенно. Контрольный замер и доливку делают через час.
Если плотность его больше, чем требуется, небольшими порциями дистиллированной воды доводят раствор до нужной концентрации. После каждой доливки делают замеры ареометром. Разбавляют до тех пор, пока показания прибора не будут превышать требуемые на 0,01 г/см³, т. к. перемешивание происходит постепенно. Контрольный замер и доливку делают через час.
Полная замена электролита
Помутнение электролита в процессе зарядки говорит о том, что срок службы аккумулятора подходит к концу. Его можно продлить самостоятельно. Сначала необходимо промыть АКБ, затем залить заново приготовленный раствор.
Помутнение дает окись свинца, находящаяся во взвешенном состоянии. Это говорит о том, что началось разрушение свинцовых пластин. При правильной эксплуатации деталей разрушения образуется немного. Но если допускать падение напряжения ниже 10 В, запускается процесс сульфатации — образования крупных кристаллов солей свинца, которые оседают на свинцовых решетках АКБ и препятствуют прохождению ионов.
Также в процессе эксплуатации снижается степень электролитической диссоциации (способности электролита распадаться на ионы). Продукты коррозии оседают на дно и при осмотре не видны. Но при зарядке происходит активное перемешивание жидкости, поэтому эти мелкие частицы черного цвета становятся видимыми. Помутнение сигнализирует о том, что нужно поменять раствор.
Необходимо отключить аккумулятор от зарядного устройства. Сливать раствор нужно в заранее приготовленную кислотоупорную емкость. Удобнее всего воспользоваться пластмассовым тазом. Сверху на него кладут 2 рейки. Переворачивают аккумулятор и ставят его на рейки так, чтобы не закрывать отверстия, электролит должен стекать свободно. Слить другим способом или выкачать его невозможно, т. к. сепараторы и пластины плотно прилегают друг к другу и заполняют внутреннее пространство банки практически под самую пробку.
Перед полной заменой электролита рекомендуется измерить его плотность с помощью ареометра.Покачивая АКБ из стороны в сторону, ждут полного вытекания жидкости.
Закончив промывку, заполняют батарею приготовленным новым раствором, ждут 2-3 часа, чтобы пропитались сепараторы. Потом делают цикл заряд+разряд и снова ставят АКБ на зарядку.
Что доливать в аккумулятор: воду или электролит
Даже при правильной эксплуатации автомобиля количество электролита постепенно уменьшается.
В этом случае доливают дистиллированную воду до меток при их наличии. Если же таковых не имеется, смотрят, чтобы сепараторы полностью находились в растворе, были погружены в жидкость на 1 см. Через 1,5-2 часа после добавления проверяют ареометром плотность в каждой банке. Выравнивают концентрацию. Для этого с помощью резиновой груши со стеклянной трубкой (изготавливается своими руками) перемещают раствор большей плотности в те банки, где она меньше.
Если при осмотре автомобиля обнаруживаются маслянистые пятна вокруг пробок аккумулятора — значит был выброс жидкости. В этом случае добавляют раствор, по плотности соответствующий региону и времени года. Через 1,5-2 часа делают замер плотности и при необходимости корректируют.
Как долить электролит в необслуживаемый аккумулятор
Необслуживаемая аккумуляторная батарея нуждается в контроле уровня и плотности электролита. Эти параметры нужно проверять ежемесячно. Обязательно делать замеры нужно осенью, перед наступлением отрицательных температур, и весной, с наступлением жаркой погоды.
Эти параметры нужно проверять ежемесячно. Обязательно делать замеры нужно осенью, перед наступлением отрицательных температур, и весной, с наступлением жаркой погоды.
Есть 3 типа АКБ с жидким кислотным электролитом:
- С пробками в верхней части корпуса аккумулятора.
- С пробками, закрытыми крышкой.
- Аккумуляторы без пробок.
Для доливки в аккумуляторы первого и второго типа нужно вывернуть все пробки из банок, визуально определить, соответствует ли уровень необходимому. Если жидкость не доходит до меток, требуется долить. При отсутствии меток можно воспользоваться чистой сухой палочкой. Аккуратно, чтобы не повредить сепараторы, опускают ее вертикально до блока пластин. Вынимают и замеряют мокрый отпечаток. Если глубина менее 0,5 мм — пополняют, используя воронку или пипетку Мора (стеклянную трубку с расширением и резиновой грушей на конце) для большей точности.
Как разобрать АКБ, чтобы долить электролит
Необслуживаемые аккумуляторы разборке не подлежат. В АКБ без пробок доливка не требуется. Двойная крышка устроена так, что испарившаяся вода конденсируется на ее поверхности и стекает обратно в батарею. Залитое при изготовлении количество жидкости рассчитано на весь срок службы аккумулятора. Если наблюдается критическое падение емкости, АКБ нужно заменить.
После замены электролита сколько нужно заряжать аккумулятор
После промывки и замены раствора следует зарядить АКБ малым током 1,5-2 А до полной зарядки — напряжения на клеммах свыше 14 В и продолжительного (свыше полутора часов) кипения жидкости во всех банках. Полная зарядка также определяется нагрузочной вилкой. Показания этого прибора должны быть выше 10 В. Измерениями нагрузочной вилкой злоупотреблять нельзя, это приводит к старению свинцовых решеток.
Полная зарядка также определяется нагрузочной вилкой. Показания этого прибора должны быть выше 10 В. Измерениями нагрузочной вилкой злоупотреблять нельзя, это приводит к старению свинцовых решеток.
Затем следует разрядить батарею до напряжения на клеммах около 10 В, не ниже. Подключают автомобильную лампочку (желательно от главных фар) к клеммам. Разряд должен идти так же медленно, как и заряжание. Периодически проверяют напряжение. При падении показателя до 10,5-11 В АКБ снова ставят на зарядку согласно рекомендациям завода-изготовителя.
Мне нравитсяНе нравитсяЗмена электролита в аккумуляторе и как приготовить пропорцию
Электролит является химическим раствором, и состоит из серной кислоты и дистиллированной воды. Состав способствует протеканию химических реакций между положительно и отрицательно заряженными свинцовыми пластинами в аккумуляторной батарее. При нормальных условиях эксплуатации АКБ требуется проводить только контроль уровня электролита и оценивать его плотность (около 1,27 г/см3).
В случае отдельных сбоев – понижение уровня, выкипание, несвоевременное обслуживание возможно изменение уровня и состояния химического раствора. Это значительно снижает срок эффективного использования АКБ, приводит к возникновению нештатных ситуаций.
Когда нужно доливать электролит в аккумулятор и как это делается
Следует учитывать, что замена электролита в АКБ не является частым процессом. В основном пользователи ограничиваются контролем уровня и состояния жидкости. Для понимания причин снижения плотности раствора следует вспомнить принцип работы электрохимической машины.
В процессе эксплуатации АКБ наиболее частой неисправностью является потеря электролитом плотности. После передачи батареей части энергии при запуске двигателя, питания других потребителей происходит последующая подзарядка. Ток поступает от генератора, или допустимо использовать внешний источник энергии. В случае недостаточного заряда возникает такой процесс, как сульфатация пластин. При разряде АКБ оксид свинца образуется в ускоренном режиме. В результате необходимые вещества изымаются из окружающего вещества, с учетом того, из чего состоит электролит для аккумуляторов. Как следствие – его плотность понижается.
В результате необходимые вещества изымаются из окружающего вещества, с учетом того, из чего состоит электролит для аккумуляторов. Как следствие – его плотность понижается.
Любой владелец авто без труда в состоянии при помощи ареометра проверить плотность раствора. Процесс намного более простой, чем замена электролита. При пониженном значении следует соотношение кислоты и воды за счет добавления раствора с начальным более высоким значением.
Для корректной оценки измерение плотности проводят на начально заряженной батарее. Возможны два варианта развития событий:
- Плотность находится в допустимых значениях – 1,25-1,27 г/см3. При малом уровне в отдельных банках следует только доливать дистиллированную воду в батарею.
- Плотность пониженная – значение от 1,20-1,25 г/см3 и ниже. Добавляют раствор с более высокой концентрацией (около 1,34 единиц).
Для повышения плотности применяют принцип замещения. Из банки с низкой плотностью грушей откачивают раствор из области над поверхностью пластин. На освободившееся место доливают раствор большей плотностью. Проводят последующий замер показателя плотности после отстоя источника тока в течение нескольких часов. После доливки уровень жидкости должен быть не выше меток, а если они отсутствуют – превышать на 5–7 мм верхнюю кромку свинцовых пластин.
На освободившееся место доливают раствор большей плотностью. Проводят последующий замер показателя плотности после отстоя источника тока в течение нескольких часов. После доливки уровень жидкости должен быть не выше меток, а если они отсутствуют – превышать на 5–7 мм верхнюю кромку свинцовых пластин.
Как поменять электролит в аккумуляторе автомобиля и когда это нужно
При контрольном осмотре могут быть обнаружены признаки, указывающие на то, что потребуется полная замена электролита:
1. Замутнение раствора, частичное изменение цвета. Для оценки состояния жидкости следует часть ее извлечь из каждой секции.
2. После частичной замены не удается добиться нужной плотности.
3. Раствор подвергался полной заморозке. К примеру, при плотности около 1,10 г/см3 (глубокий разряд) заморозка произойдет при 7–8 градусах мороза.
Кислотный состав нормальной плотности выдержит отрицательную температуру на уровне ниже -54 °С.
Полная замена электролита в аккумуляторе начинается с извлечения прежнего раствора. Ни в коем случае не следует сливать жидкость из банок путем наклона батареи. Стоит помнить, из чего состоит АКБ. Свинцовый осадок со дна с легкостью закоротит разно полярные пластины, попав между ними.
Ни в коем случае не следует сливать жидкость из банок путем наклона батареи. Стоит помнить, из чего состоит АКБ. Свинцовый осадок со дна с легкостью закоротит разно полярные пластины, попав между ними.
До начала замены электролита в автомобильном аккумуляторе следует приготовить подручные инструменты: емкость для старой жидкости, воронку, приспособления для откачки жидкости.
Поменять электролит легче, постепенно отсасывая грушей или шприцом прежний раствор из каждой секции. Предварительно корпус аккумулятора очищают от загрязнений. После откачки для замены электролита в АКБ выполняют последовательные действия:
- проводят промывку внутренней полости, заливая дистиллированную воду до необходимого уровня;
- заливают свежий раствор плотностью 1,27 единиц.
Для обретения второй жизни заменить электролит в аккумуляторе автомобиля недостаточно. Потребуется зарядка устройства с соблюдением режима.
После замены электролита сколько нужно заряжать аккумулятор
Прежде чем заряжать аккумулятор после замены электролита, дайте отстояться АКБ несколько часов. Разрешено покачать корпус с целью удаления пузырьков воздуха.
Разрешено покачать корпус с целью удаления пузырьков воздуха.
Режим зарядки АКБ предполагает использование малых зарядных токов – 0,1А. Процесс проводят по циклу – заряд-разряд, контролируя плотность. Не следует допускать излишнего кипячения раствора с учетом возможной потери концентрации воды.
При обнаружении излишней сульфатации свинцовых пластин допускается использовать присадку для растворения налета. На качество нового раствора этот процесс не повлияет. Время полного растворения оксида составляет около 2 суток.
Окончательный замер плотности и степени зарядки проводится не ранее чем через два часа после отключения батареи от зарядного устройства. При контроле тестером на полную зарядку укажет напряжение на клеммах на уровне 14–15 В. Но процесс следует продолжить в течение еще двух часов, чтобы убедиться на стабильность показателя плотности.
Как приготовить электролит для аккумулятора
Если с вопросом как заменить электролит в аккумуляторе все становится ясно, то остается приготовить химический раствор. На сегодняшний день приготовление электролита не является острой необходимостью. Кислотный состав плотностью 1,27 г/см3 доступен в свободной продаже.
На сегодняшний день приготовление электролита не является острой необходимостью. Кислотный состав плотностью 1,27 г/см3 доступен в свободной продаже.
В зависимости от размеров и электрической емкости батареи будет отличаться объем приготавливаемой жидкости. Для большинства легковых моделей не понадобится жидкости более 2,6-3,7 литра. Стоит заранее высчитать объем необходимых ингредиентов с учетом конечного объема с запасом — около 4 литров.
Теоретически, приготовление электролита для аккумуляторов плотностью 1,28 единиц включает в себя следующие пропорции:
- дистиллированная вода – 1 л;
- серная кислота – 0,33 л.
При смешивании важно помнить, как правильно вливать компоненты – в воду льют кислоту. Перемешивать не нужно, при постепенном добавлении процесс успешно протекает самостоятельно. По окончании приготовления раствора оставляют его на 12 часов, по истечении которых проводят замер плотности.
В случае самостоятельного приготовления следует учитывать, что серная кислота должна иметь отличную степень чистоты, что требуется стандартом. Допустимое содержание примесей – не более 7%.
Допустимое содержание примесей – не более 7%.
Использование h3SO4 неизвестного происхождения не позволит заменить электролит в аккумуляторе автомобиля с успехом.
В случае использования щелочного аккумулятора процесс замены рабочей среды несколько отличается. Для приготовления щелочного электролита используют готовый сухой щелочной электролит – обычно Натрий-Литиевый. Этот состав смешивают в нужной пропорции с дистиллированной водой.
К примеру, для традиционной концентрации 1,27 г/см3 используют соотношение сухая смесь/готовый раствор как 1 к 2 частям. Более подробно следует прочитать инструкцию к смеси, а также изучить рекомендации производителя отдельной модели источника тока.
Следует внимательно отнестись к утилизации старого состава. Не экологично сливать его просто в канализацию или землю. Обратитесь в специальные службы по сбору кислоты.Проведенная работа не потребует значительных финансовых и временных затрат. В ответ владелец авто получит надежный запуск двигателя в любой сезон года.
Видео про замену электролита в аккумуляторе
Как заменить электролит в аккумуляторе автомобиля: уровень, плотность, необходимые инструменты
С заменой электролита в аккумуляторе автомобиля тянуть не стоит, если модель батареи обслуживаемая. АКБ таких видов позволяют анализировать плотность жидкости в секциях и состояние кислоты, понижать или повышать её уровень. Бывают ещё необслуживаемые аккумуляторы, которые можно только дозаряжать.
Для чего меняют электролит в аккумуляторе
За новый аккумуляторный электролит автомобиль и его электросистема «скажут» только спасибо. Однако замена должна быть осуществлена грамотно, это исключит риск возникновения проблем в дальнейшем. Если же провести процедуру без ошибок, не придётся покупать новую аккумуляторную батарею.
Однако замена должна быть осуществлена грамотно, это исключит риск возникновения проблем в дальнейшем. Если же провести процедуру без ошибок, не придётся покупать новую аккумуляторную батарею.
Плотность электролита в аккумуляторе автомобиля должна составлять 1,28 г на куб. см. Рекомендуется добавлять в жидкость полезные присадки, расщепляющие сульфаты. Пользоваться батареей после замены жидкости можно не раньше, чем через 96 часов. За это время воздух полностью выйдет из аккумулятора, а добавленные присадки успеют раствориться.
Специалисты это прекрасно знают, поэтому оставляют аккумулятор у себя на несколько суток. Однако если владелец батареи требует скорой услуги, он должен понимать, что могут быть последствия и в этом кроме него никто не будет виноват.
Как заменить электролит правильно?
Снижение плотности кислоты — распространённый дефект АКБ, образующийся в ходе эксплуатации машины. Основными причинами этого становятся сульфатация пластин, старение или проблемы с зарядкой (перезаряд/недозаряд).
Рассмотрим процесс сульфатации подробнее. Он возникает из-за недостаточности заряда АКБ — внутри аккумуляторных решёток репродуцируется свинцовый оксид и зарождается окислительный процесс. Возросший процент сульфата свинца приводит к уменьшению плотности серной кислоты, являющейся основой электролита. Специальным прибором под названием «ареометр» надо измерить плотность, после чего увеличить её до идеального показателя.
Вот как заменить электролит в аккумуляторе автомобиля, чтобы избежать банальных ошибок:
- плотность надо измерять на полностью заряжённом аккумуляторе;
- количес
Как заменить электролит в аккумуляторе
Электролит является важнейшим компонентом свинцово-кислотной аккумуляторной батареи. Это рабочая жидкость, благодаря которой между отрицательными и положительными пластинами могут протекать электрохимические процессы.
Срок службы даже самых современных АКБ обычно не превышает 5–6 лет. Встречаются и более «живучие» устройства, но тут многое зависит уже от соблюдения правил эксплуатации и обслуживания.
Встречаются и более «живучие» устройства, но тут многое зависит уже от соблюдения правил эксплуатации и обслуживания.
Обидно, когда отказ батареи происходит уже через пару лет после покупки. Потому автомобилисты стремятся тем или иным образом продлить жизнь источнику питания. Существует несколько способов добиться желаемого. Один из них предусматривает замену электролита. Процедура достаточно простая и финансово выгодная. Тут главное – соблюдать правила и рекомендации при замене рабочей жидкости.
Зачем и в каких ситуациях проводится замена
Для начала нужно разобраться с особенностями замены электролита в аккумуляторах и понять, когда и зачем это делается.
Существует достаточно распространённое мнение или даже, скорее, миф. Некоторые автомобилисты в него искренне верят. Они уверены, что периодическая полная замена электролита в автомобильном аккумуляторе – процедура просто необходимая. Это якобы один из методов профилактики, позволяющий продлить срок службы АКБ.
В действительности это не так.
При соблюдении правил эксплуатации залитый на производстве электролит служит полный срок и утилизируется вместе с АКБ. Потребоваться может только контроль состояния, уровня и доливка дистиллированной воды.
На вопрос о том, надо ли менять старый электролит в аккумуляторах, можно ответить следующим образом. Обойтись без замены можно лишь в идеальных условиях. На практике добиться их удаётся не так часто.
Среди наиболее распространённых ситуаций, когда замена всё же может потребовать
Как приготовить состав электролита для аккумулятора
Мощные аккумуляторные батареи, используемые на транспорте и в промышленности, в качестве электрохимического реагента используют кислотные или щелочные растворы. Как правило, залитая в АКБ жидкость рассчитана на весь срок эксплуатации источника питании. Но зачастую со временем электролит деградирует (теряет свои свойства) – из-за загрязнения или в результате замерзания при отрицательных температурах. Помутневший раствор меняют, но необязательно покупать готовую жидкость – её можно приготовить в домашних условиях. Эта не слишком сложная операция позволит вам сэкономить часть денежных средств.
Как правило, залитая в АКБ жидкость рассчитана на весь срок эксплуатации источника питании. Но зачастую со временем электролит деградирует (теряет свои свойства) – из-за загрязнения или в результате замерзания при отрицательных температурах. Помутневший раствор меняют, но необязательно покупать готовую жидкость – её можно приготовить в домашних условиях. Эта не слишком сложная операция позволит вам сэкономить часть денежных средств.
Состав электролита для аккумуляторов
В наиболее распространённых свинцово-кислотных батареях в качестве электролита используется водный раствор серной кислоты, достаточно концентрированный.
В щелочных батареях основным активным веществом является антипод кислоты – щёлочь, в состав электролита для щелочных аккумуляторов входят едкий калий и та же дистиллированная вода.
Поскольку преобладающими в автопроме являются кислотные аккумуляторы, рассмотрим состав электролита этого типа более подробно.
Серная кислота представляет собой прозрачную жидкость маслянистой концентрации, которая гораздо тяжелее воды. Она хорошо в ней растворяется и не имеет характерного запаха. Процесс смешивания серной кислоты с водой сопровождается выделением тепловой энергии, поэтому рекомендуется выполнять эту операцию с особой тщательностью и аккуратностью.
Она хорошо в ней растворяется и не имеет характерного запаха. Процесс смешивания серной кислоты с водой сопровождается выделением тепловой энергии, поэтому рекомендуется выполнять эту операцию с особой тщательностью и аккуратностью.
Допускается использование кислоты согласно двум госстандартам – ГОСТ 0142б2-78 и ГОСТ 0667-83. Они практически равноценны и предписывают использование моногидрата H2SO4 в концентрации до 94%, с совокупным содержанием примесей на уровне не более 0.0367%, включая 0.0001% марганца и столько же мышьяка, 0.013% железа, 0.0005% хлора. Плотность кислоты –1.83 г/см3.
Второй компонент – дистиллированная, то есть подвергшаяся глубокой очистке вода Использование речной, водопроводной, а тем более технической воды не допускается. Согласно ГОСТу 06709-72, возможно использование воды, полученной их конденсата паротурбинных силовых установок, при этом такая жидкость д
Что такое аккумулятор? — learn.sparkfun.com
Добавлено в избранное Любимый 20Введение
Батареи — это совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны проходить через цепь и возвращаться на катод, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может быть использован в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбрасывать после использования, известны как первичные батареи .Аккумуляторы, которые можно перезаряжать, называются вторичными батареями и .
Литий-полимерные батареи, например, можно заряжать
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную провернуть машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к сети (как в старые добрые времена).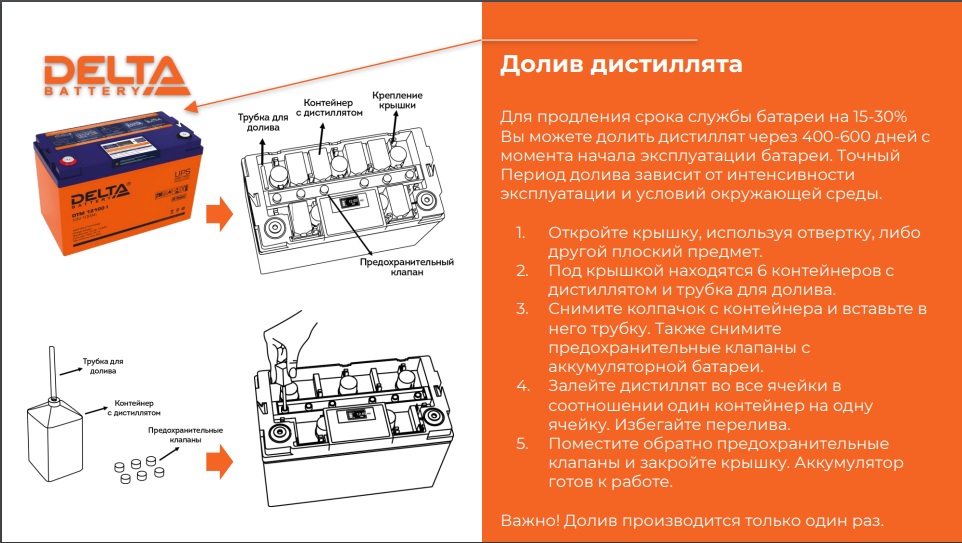 Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218 Это ваши стандартные щелочные батарейки на 9 вольт от Rayovac. Даже не думайте пытаться перезарядить их. Используйте их с…
Даже не думайте пытаться перезарядить их. Используйте их с…
История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в случае артиллерийской батареи. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, соединенных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу о том, что импульсы лягушачьей лапки на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из пакета цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления к гальванической свае
Уильям Крукшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «элемент Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химия вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, а свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначались для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую «сухую» батарею в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> Цинк-угольная батарея 3 В 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Японская компания Asahi Chemical создала первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году. В конце 1990-х годов для литий-ионных аккумуляторов был создан мягкий гибкий корпус, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
В конце 1990-х годов для литий-ионных аккумуляторов был создан мягкий гибкий корпус, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но вы поняли. Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Лучшее поперечное сечение щелочной ячейки можно найти в Википедии. И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На аккумуляторах катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде. Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, способное переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения
(Изображение любезно предоставлено Wiliam Davies из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены.
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству батарей требуется способ удерживать химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса аккумуляторов могут быть изготовлены практически из чего угодно: из пластика, стали, мягких пластиковых пакетов и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной кожух соединен с катодом.
В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной кожух соединен с катодом.
Операция
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри анода или вокруг него, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде дает дополнительные электроны в процессе, называемом окислением , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части. Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Окислительно-восстановительные реакции происходят, когда электроны переносятся между химическими веществами. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
Некоторые реакции окисления образуют ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления. В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже когда батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задыхаются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», для выполнения чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Батарея разряжена
Химические вещества в батарее в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении аккумулятора, емкости, возможности источника тока и так далее.
Ячейка
Элемент относится к одному аноду и катоду, разделенным электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек. Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг над другом
Первичный
Первичные клетки содержат химический состав, который нельзя изменить. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, также известные как «аккумуляторные батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo-элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение всего цикла разряда.
Вместимость
Емкость аккумулятора — это мера количества электрического заряда, который он может доставить при определенном напряжении. Большинство батарей рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывает напряжение батареи как функцию от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-скорость
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это количество тока, необходимое для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при повышенном потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких скоростях C.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или меньше.
MIT предлагает фантастическое руководство по спецификациям и терминологии аккумуляторов, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот экран для фотонной батареи питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки 1,5 В соединены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или литий-полимерные батареи последовательно, вам необходимо обязательно использовать специальные схемы, известные как «балансировщик», чтобы обеспечить равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельно
Если напряжение отдельной ячейки соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какая-либо разница в напряжении, может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серияи параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, так как может произойти короткое замыкание.
В этом примере общее напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация для схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батарейки и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, которые используют разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Состав электролита контролирует работу аккумулятора
Мы обнаружили, что добавление воды значительно снижает разницу в напряжении (перенапряжения) между зарядкой / разрядкой.Кредит: АВТОРСКОЕ ПРАВО (C) ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ ТОЙОХАШИ. Исследовательская группа кафедры электротехнической и электронной информации Технологического университета Тоёхаси сообщила, что добавление воды в электролит улучшает функцию оксида ванадия, материала положительного электрода в ионно-кальциевых батареях. Хотя известно, что вода в электролитах вызывает множество отрицательных эффектов, теперь было обнаружено, что она вызывает явление, которое ускоряет обычно медленную реакцию кальций-ионных батарей.Результаты показывают, что это явление вызвано изменениями в структуре электролита. Исследователи полагают, что это открытие принесет большую пользу при разработке электролитов для реализации кальций-ионных батарей в будущем.
Хотя известно, что вода в электролитах вызывает множество отрицательных эффектов, теперь было обнаружено, что она вызывает явление, которое ускоряет обычно медленную реакцию кальций-ионных батарей.Результаты показывают, что это явление вызвано изменениями в структуре электролита. Исследователи полагают, что это открытие принесет большую пользу при разработке электролитов для реализации кальций-ионных батарей в будущем.
Вторичные батареи являются ценным ресурсом для различных отраслей промышленности. Сегодня вторичные батареи необходимы для многоразовой энергии и электромобилей.Литий-ионные вторичные батареи уже широко используются в качестве мощных вторичных батарей. Однако в последние годы безопасность вторичных батарей подвергается сомнению, и в бесчисленных отчетах упоминается возгорание. Ожидается, что потребность во вторичных батареях будет расти в геометрической прогрессии вместе с ростом количества электромобилей.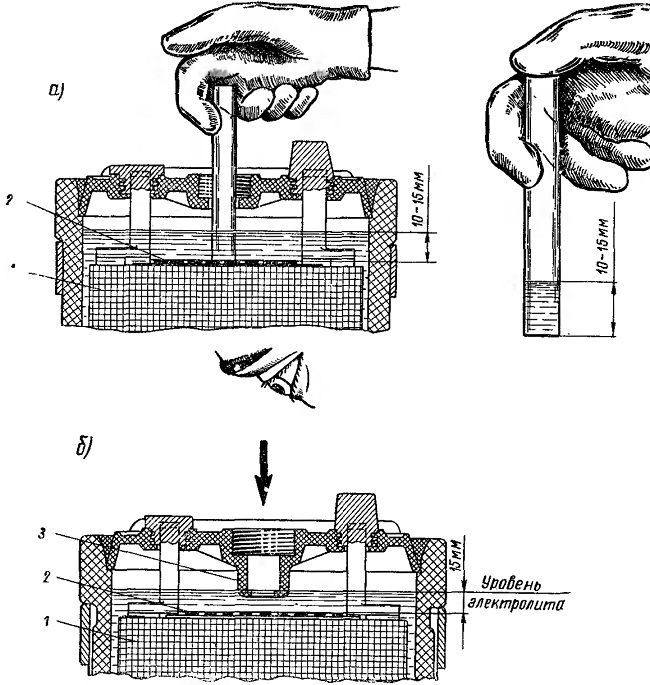 Это означает более высокий спрос на литий и, в свою очередь, такие проблемы, как более высокие цены и потенциальное истощение ресурсов.
Это означает более высокий спрос на литий и, в свою очередь, такие проблемы, как более высокие цены и потенциальное истощение ресурсов.
Кальциево-ионные батареи — это тип вторичных батарей нового поколения, в которых не используется литий и которые могут достигать напряжения батареи, которое может соперничать с литий-ионными батареями.По сравнению с литий-ионными батареями кальциево-ионные батареи безопаснее, дешевле в производстве, а их ресурсы намного больше. Однако с кальциево-ионными батареями по-прежнему существует ряд проблем. Одна из таких проблем заключается в том, что они работают со скоростью намного меньшей, чем у литий-ионных батарей.
Добавление воды приводит к уменьшению содержания органического растворителя вокруг иона кальция и увеличению содержания воды. Вода также вызывает важные структурные изменения: отрицательный ион отделяется от иона кальция.Предоставлено: Технологический университет Тоёхаси. В этом исследовании Университет Тоёхаси сообщил, что медленную скорость работы кальциево-ионных батарей можно улучшить, добавив в электролит воду. Графики результатов испытаний показывают, что перенапряжение, возникающее во время зарядки / разрядки, значительно уменьшается с увеличением количества добавленной воды, и эта реакция протекает без каких-либо проблем. Исследователи доказали, что это явление вызвано тем, что структура электролита сильно изменяется при добавлении воды.
Графики результатов испытаний показывают, что перенапряжение, возникающее во время зарядки / разрядки, значительно уменьшается с увеличением количества добавленной воды, и эта реакция протекает без каких-либо проблем. Исследователи доказали, что это явление вызвано тем, что структура электролита сильно изменяется при добавлении воды.
Ёсиаки Мурата, доктор философии студент и первый автор исследования говорит: «Электролит состоит из положительных ионов (ионов кальция), отрицательных ионов и молекул растворителя, и состояние вокруг иона кальция сильно изменяется при добавлении воды. Это означает, что, Чтобы улучшить характеристики кальциево-ионной батареи, желательно, чтобы отрицательный ион не был присоединен к иону кальция в электролите, а молекула растворителя, которая легко отделяется, присоединяется к иону кальция. Хотя нам все еще необходимо найти электролит с этими характеристики, которые не включают воду, чтобы получить ионно-кальциевые батареи, открытие этого явления, несомненно, поможет в разработке электролитов в будущем. «
«
Результат настоящего исследования фактически был вторичным результатом, полученным при изучении новых электролитов. Электролиты должны быть в достаточной степени обезвожены, когда они проявятся, но этот процесс обезвоживания труден. Настоящее исследование проводилось в связи с улучшением характеристик аккумулятора при тестировании недостаточно обезвоженного электролита.Хотя есть сообщения о явлении, при котором характеристики, например, ионно-магниевого аккумулятора улучшаются из-за добавления воды, механизм этого не был четко известен. Было удивительно, что то же явление можно наблюдать в кальциево-ионных батареях, и мы считаем, что выяснение механизма, лежащего в основе этого поведения, окажется полезным для будущего развития электролитов.
Наша исследовательская группа стремится разработать и оценить новые электролиты на основе этой недавно обнаруженной структуры электролита, которая улучшает характеристики кальциево-ионных батарей. Более того, мы были не единственными, кто это изучал; В последние годы наблюдается стремительный рост количества исследований кальциево-ионных батарей. В конечном итоге мы хотели бы разработать кальциево-ионную батарею, которая сможет конкурировать или обгонять литий-ионные батареи.
Более того, мы были не единственными, кто это изучал; В последние годы наблюдается стремительный рост количества исследований кальциево-ионных батарей. В конечном итоге мы хотели бы разработать кальциево-ионную батарею, которая сможет конкурировать или обгонять литий-ионные батареи.
Совершенно ясно: кристалличность снижает сопротивление в твердотельных аккумуляторах
Дополнительная информация: Йошиаки Мурата и др., Влияние воды в электролите на свойства введения / извлечения Ca 2 + V2O5, Electrochimica Acta (2018).DOI: 10.1016 / j.electacta.2018.10.103 Предоставлено Технологический университет Тоёхаси
Цитата :
Структура электролита контролирует работу аккумулятора (5 декабря 2018 г. )
получено 22 декабря 2020
с https: // физ.org / news / 2018-12-electrolyte-battery.html
)
получено 22 декабря 2020
с https: // физ.org / news / 2018-12-electrolyte-battery.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Определение, функции, дисбаланс и источники
Электролиты участвуют во многих важных процессах в организме.
Они играют роль в проведении нервных импульсов, сокращении мышц, поддержании гидратации и регулировании уровня pH в организме (1, 2, 3, 4).
Следовательно, вам необходимо получать достаточное количество электролитов из своего рациона, чтобы ваше тело функционировало должным образом.
В этой статье подробно рассматриваются электролиты, их функции, риск дисбаланса и возможные источники.
«Электролит» — общий термин для частиц, несущих положительный или отрицательный электрический заряд (5).
В питании этот термин относится к важным минералам, содержащимся в крови, поте и моче.
Когда эти минералы растворяются в жидкости, они образуют электролиты — положительные или отрицательные ионы, используемые в метаболических процессах.
К электролитам, содержащимся в вашем теле, относятся:
Эти электролиты необходимы для различных процессов в организме, включая правильную работу нервов и мышц, поддержание кислотно-щелочного баланса и поддержание гидратации.
РезюмеЭлектролиты — это минералы, несущие электрический заряд.Они содержатся в крови, моче и поте и имеют жизненно важное значение для определенных процессов, которые поддерживают нормальное функционирование вашего тела.
Электролиты имеют решающее значение для поддержания функционирования нервной системы и мышц, а также для поддержания баланса внутренней среды.
Нервная система Функция
Ваш мозг посылает электрические сигналы через нервные клетки, чтобы общаться с клетками по всему телу.
Эти сигналы называются нервными импульсами, и они генерируются изменениями электрического заряда мембраны нервной клетки (6).
Изменения происходят из-за движения электролита натрия через мембрану нервной клетки.
Когда это происходит, запускается цепная реакция, перемещая больше ионов натрия (и изменение заряда) по длине аксона нервной клетки.
Функция мышц
Электролит кальция необходим для сокращения мышц (7).
Позволяет мышечным волокнам скользить вместе и перемещаться друг над другом, поскольку мышцы укорачиваются и сокращаются.
Магний также необходим в этом процессе, чтобы мышечные волокна могли скользить наружу, а мышцы расслаблялись после сокращения.
Правильная гидратация
Вода должна храниться в нужном количестве как внутри, так и снаружи каждой клетки вашего тела (8).
Электролиты, особенно натрий, помогают поддерживать баланс жидкости за счет осмоса.
Осмос — это процесс, при котором вода движется через стенку клеточной мембраны из разбавленного раствора (больше воды и меньше электролитов) в более концентрированный раствор (меньше воды и больше электролитов).
Это предотвращает разрыв клеток от переполнения или сморщивания из-за обезвоживания (9).
Внутренние уровни pH
Чтобы оставаться здоровым, вашему организму необходимо регулировать свой внутренний pH (10).
pH — это показатель кислотности или щелочности раствора. В вашем теле это регулируется химическими буферами или слабыми кислотами и основаниями, которые помогают минимизировать изменения во внутренней среде.
Например, уровень pH в вашей крови должен оставаться в пределах 7,35–7,45. Если он отклоняется от этого, ваше тело не может функционировать должным образом, и вы заболеете.
Правильный баланс электролитов имеет основополагающее значение для поддержания уровня pH в крови (10).
РезюмеЭлектролиты необходимы для поддержания функционирования нервной системы и мышц. Они также обеспечивают оптимальную внутреннюю среду вашего тела, сохраняя гидратацию и помогая регулировать внутренний pH.
В некоторых случаях уровень электролитов в крови может стать слишком высоким или низким, вызывая дисбаланс (11, 12, 13).
Нарушения электролитов могут нанести вред вашему здоровью, а в редких случаях даже привести к летальному исходу (14).
Дисбаланс электролитов часто возникает из-за обезвоживания, вызванного чрезмерным нагревом, рвотой или диареей. Вот почему вы должны помнить о восполнении любых потерянных жидкостей, когда вам жарко или когда вы больны (15).
Некоторые болезни, в том числе болезни почек, расстройства пищевого поведения и травмы, такие как тяжелые ожоги, также могут вызывать нарушение электролитного баланса (16, 17, 18, 19).
Если у вас легкое нарушение электролитного баланса, у вас, вероятно, не будет никаких симптомов.
Однако более серьезные дисбалансы могут вызывать такие симптомы, как (20, 21):
- Усталость
- Быстрое или нерегулярное сердцебиение
- Онемение и покалывание
- Путаница
- Слабость и спазмы мышц
- Головные боли
- Судороги
Если вы подозреваете, что у вас дисбаланс электролитов, обязательно обсудите свои симптомы с врачом.
РезюмеЭлектролитный дисбаланс чаще всего возникает, когда люди сильно обезвожены из-за рвоты, диареи или чрезмерного потоотделения. Сильный дисбаланс может мешать функционированию вашего тела.
Когда вы потеете, вы теряете воду и электролиты, особенно натрий и хлорид.
В результате длительные упражнения или активность, особенно в жару, могут вызвать значительную потерю электролитов.
По оценкам, пот в среднем содержит около 40–60 ммоль натрия на литр (22).
Но фактическое количество электролитов, теряемых с потом, может варьироваться от человека к человеку (23, 24).
В США максимальная рекомендуемая доза натрия составляет 2300 мг в день, что эквивалентно 6 граммам или 1 чайной ложке поваренной соли (25).
Поскольку около 90% взрослых американцев потребляют намного больше, большинству людей не требуется восполнять потерю натрия с потом (26).
Тем не менее, некоторые группы населения, такие как спортсмены на выносливость, которые тренируются более двух часов, или те, кто тренируется в сильную жару, могут захотеть рассмотреть возможность употребления спортивных напитков, обогащенных электролитами, чтобы восполнить свои потери (27).
Для всех остальных достаточно получать нормальное количество натрия из пищи и питьевой воды, чтобы оставаться гидратированным.
СводкаКогда вы потеете, вы теряете воду и электролиты, особенно натрий. Тем не менее, натрия, потребляемого с пищей, обычно достаточно, чтобы покрыть любые потери.
Лучший способ достичь и поддерживать баланс электролитов — это здоровое питание.
Основными пищевыми источниками электролитов являются фрукты и овощи.Однако в западной диете обычным источником натрия и хлоридов является поваренная соль.
Ниже приведены некоторые продукты, содержащие электролиты (28, 29, 30):
- Натрий: Маринованные продукты, сыр и поваренная соль.
- Хлорид: Соль поваренная.
- Калий: Фрукты и овощи, такие как бананы, авокадо и сладкий картофель.
- Магний: Семена и орехи.
- Кальций: Молочные продукты, витаминизированные заменители молока и зеленые листовые овощи.
Электролиты, такие как бикарбонат, вырабатываются естественным путем в организме, поэтому вам не нужно беспокоиться о том, чтобы включить их в свой рацион.
РезюмеЭлектролиты содержатся во многих продуктах питания, включая фрукты, овощи, молочные продукты, орехи и семена.
Некоторые люди пьют воду с электролитом или добавляют электролиты, такие как натрий и кальций, чтобы получить достаточно.
Однако сбалансированной диеты, включающей источники электролитов, должно хватить для большинства.
Ваше тело обычно может эффективно регулировать электролиты и поддерживать их на нужном уровне.
Но в некоторых случаях, например, во время приступов рвоты и диареи, когда потери электролитов чрезмерны, может оказаться полезным добавление раствора для регидратации, содержащего электролиты (31).
Сумма, которую вам нужно будет израсходовать, будет зависеть от ваших потерь. Всегда читайте инструкции по замене без рецепта.
Также обратите внимание, что если у вас не низкий уровень электролитов из-за чрезмерных потерь, то прием добавок может вызвать аномальный уровень и, возможно, болезнь (32).
Перед добавлением электролитов лучше сначала проконсультироваться с врачом или фармацевтом.
РезюмеЕсли вы придерживаетесь сбалансированной диеты, которая содержит хорошие источники электролитов, добавки обычно не нужны.
Электролиты — это минералы, которые несут электрический заряд при растворении в воде.
Они жизненно важны для вашей нервной системы, мышц и поддержания оптимальной среды тела.
Большинство людей удовлетворяют свои потребности в электролитах за счет сбалансированной диеты, хотя может возникнуть дисбаланс, если вы обезвожены из-за болезни или перегрева.
Если вы подозреваете, что у вас дисбаланс электролитов, поговорите со своим врачом.
Автомобильные аккумуляторные батареи и аккумуляторные батареи глубокого разряда Часто задаваемые вопросы (FAQ) Раздел 16
Автомобильные аккумуляторные батареи и аккумуляторные батареи глубокого разряда Часто задаваемые вопросы (FAQ) Раздел 1616. КАК Я МОГУ ВОССТАНОВИТЬ СУЛЬФИРОВАННЫЙ АККУМУЛЯТОР?
ИНДЕКС:
16.1. Как я могу узнать, есть ли в моей батарее постоянная сульфатация?
16.2. Как предотвратить перманентную сульфатацию?
16.3. Как мне восстановить сульфатированные батареи?
16. 4. Где я могу найти дополнительную информацию о сульфатировании?
4. Где я могу найти дополнительную информацию о сульфатировании?
«Люди убивают больше батарей глубокого цикла из-за неправильного обслуживания, чем умирают от старости!»
Сульфатирование свинца фактически начинается, когда вы снимаете напряжение зарядки свинцово-кислотного аккумулятора. Кристаллы сульфата свинца снова превращаются в свинец во время нормального цикла зарядки. Реальный вопрос заключается в том, что если все кристаллы сульфата свинца не превратятся обратно в свинец, сколько времени пройдет, прежде чем они станут настолько твердыми, что их нельзя будет преобразовать? Ответ может варьироваться — это могут быть недели или месяцы и зависит от ряда факторов, таких как качество свинца, температура, химический состав пластины, пористость, глубина разряда (DoD), стратификация электролита и т. Д. Пористость — это мера пористости пластин.
Во время нормального процесса разряда свинец и сера объединяются в мягкие кристаллы сульфата свинца, которые образуются в порах и на поверхностях положительных и отрицательных пластин внутри свинцово-кислотной батареи. Когда аккумулятор остается в разряженном состоянии, постоянно недозаряжен, уровень электролита ниже верха пластин или электролит расслаивается, часть мягкого сульфата свинца перекристаллизовывается в твердый сульфат свинца, и он не может быть повторно преобразован во время последующего подзарядка.Это образование твердых кристаллов обычно называют постоянным или твердым «сульфатированием» . Когда он присутствует, аккумулятор показывает более высокое напряжение, чем его истинное напряжение; таким образом, обманывая регулятор напряжения или интеллектуальное зарядное устройство, заставляя думать, что аккумулятор полностью заряжен. Это приводит к тому, что зарядное устройство преждевременно снижает выходное напряжение или ток, в результате чего аккумулятор остается недозаряженным. Если залитый (влажный) свинцово-кислотный аккумулятор периодически не перезаряжается, недостаточно заряжается или не обслуживается должным образом, на сульфатирование приходится примерно 85% преждевременных отказов аккумуляторов.
Когда аккумулятор остается в разряженном состоянии, постоянно недозаряжен, уровень электролита ниже верха пластин или электролит расслаивается, часть мягкого сульфата свинца перекристаллизовывается в твердый сульфат свинца, и он не может быть повторно преобразован во время последующего подзарядка.Это образование твердых кристаллов обычно называют постоянным или твердым «сульфатированием» . Когда он присутствует, аккумулятор показывает более высокое напряжение, чем его истинное напряжение; таким образом, обманывая регулятор напряжения или интеллектуальное зарядное устройство, заставляя думать, что аккумулятор полностью заряжен. Это приводит к тому, что зарядное устройство преждевременно снижает выходное напряжение или ток, в результате чего аккумулятор остается недозаряженным. Если залитый (влажный) свинцово-кислотный аккумулятор периодически не перезаряжается, недостаточно заряжается или не обслуживается должным образом, на сульфатирование приходится примерно 85% преждевременных отказов аккумуляторов. Чем дольше происходит сульфатирование, тем крупнее и твердее становятся кристаллы сульфата свинца. Положительные пластины будут светло-коричневыми , а отрицательные пластины будут тусклыми и не совсем белыми. Эти кристаллы снижают производительность, емкость и способность батареи удерживать заряд или перезаряжаться. Это происходит в глубоком цикле, и некоторые пусковые батареи обычно используются в течение коротких периодов времени, сезонных спортивных состязаний или приложений, отпусков, поездок на выходные и т. Д., А затем хранятся в остальное время года для медленного естественного саморазряда.Большинство пусковых батарей обычно используются несколько раз в месяц, поэтому постоянное сульфатирование редко становится проблемой, если только они недостаточно заряжены или пластины не покрыты электролитом.
Чем дольше происходит сульфатирование, тем крупнее и твердее становятся кристаллы сульфата свинца. Положительные пластины будут светло-коричневыми , а отрицательные пластины будут тусклыми и не совсем белыми. Эти кристаллы снижают производительность, емкость и способность батареи удерживать заряд или перезаряжаться. Это происходит в глубоком цикле, и некоторые пусковые батареи обычно используются в течение коротких периодов времени, сезонных спортивных состязаний или приложений, отпусков, поездок на выходные и т. Д., А затем хранятся в остальное время года для медленного естественного саморазряда.Большинство пусковых батарей обычно используются несколько раз в месяц, поэтому постоянное сульфатирование редко становится проблемой, если только они недостаточно заряжены или пластины не покрыты электролитом.
Вследствие паразитных (отключенных) нагрузок или естественного саморазряда происходит постоянное сульфатирование, когда залитый (влажный) свинцово-кислотный аккумулятор разряжается во время длительного хранения. Паразитная нагрузка — это постоянная электрическая нагрузка, присутствующая на аккумуляторе, когда он установлен в транспортном средстве, даже когда питание отключено.Нагрузка возникает из-за непрерывной работы приборов, таких как блок управления выбросами, часы, система безопасности, поддержание предустановок радиостанций и т. Д. Отсоединение отрицательного кабеля аккумулятора устраняет паразитную нагрузку, но не влияет на естественное состояние человека. -разряд свинцово-кислотного аккумулятора. Саморазряд ускоряется температурой. Для батарей, температура которых превышает 25 ° C (77 ° F), скорость саморазряда удваивается при повышении температуры на 18 ° F (10 ° C). Таким образом, сульфатирование представляет собой огромную проблему для залитых (мокрых) свинцово-кислотных аккумуляторов, которые не используются, находятся на полке дилера или в хранящемся автомобиле, особенно при температурах HOT .
Паразитная нагрузка — это постоянная электрическая нагрузка, присутствующая на аккумуляторе, когда он установлен в транспортном средстве, даже когда питание отключено.Нагрузка возникает из-за непрерывной работы приборов, таких как блок управления выбросами, часы, система безопасности, поддержание предустановок радиостанций и т. Д. Отсоединение отрицательного кабеля аккумулятора устраняет паразитную нагрузку, но не влияет на естественное состояние человека. -разряд свинцово-кислотного аккумулятора. Саморазряд ускоряется температурой. Для батарей, температура которых превышает 25 ° C (77 ° F), скорость саморазряда удваивается при повышении температуры на 18 ° F (10 ° C). Таким образом, сульфатирование представляет собой огромную проблему для залитых (мокрых) свинцово-кислотных аккумуляторов, которые не используются, находятся на полке дилера или в хранящемся автомобиле, особенно при температурах HOT .
«Все свинцово-кислотные аккумуляторы скоропортящиеся!»
16. 1. Как я могу узнать, есть ли в моей батарее постоянная сульфатация?
1. Как я могу узнать, есть ли в моей батарее постоянная сульфатация?
Скорее всего, в вашей батарее есть постоянная сульфатация, если она демонстрирует одно или несколько из следующих условий:
- Если не будет «брать» заряд или «держать» подзарядку.
- Особенно, если температура в зоне хранения постоянно превышала 77 ° F (25 ° C), если ваш залитый (влажный) стандартный (Sb / Sb) или затопленный (мокрый) малообслуживаемый аккумулятор (Sb / Ca) не заряжался. на срок более трех месяцев, аккумулятор «Необслуживаемый» (Ca / Ca) на шесть месяцев и аккумулятор AGM (Ca / Ca) или гелевый элемент (Ca / Ca) VRLA на один год.
- При подзарядке в хорошо проветриваемом помещении в течение ожидаемого времени для зарядки батареи амперметр не опускается ниже 2% от номинального значения ампер-часов (C / 20), а также батарея теплая или горячая. Например, если у вас есть зарядное устройство на десять ампер и полностью разряженная батарея с номинальной емкостью 60 ампер-часов (C / 20) или 100 минут с резервной емкостью, батарея должна быть полностью заряжена в течение 12 часов.
 Повышенное потребление воды также может указывать на наличие сульфатирования.
Повышенное потребление воды также может указывать на наличие сульфатирования. - Если емкость полностью заряженного аккумулятора меньше 80% от его номинальной емкости в ампер-часах после испытания под нагрузкой.
- Если удельный вес всех ячеек низкий после того, как батарея была на зарядном устройстве в течение ожидаемого времени зарядки.
- Если напряжение абсорбционной зарядки с температурной компенсацией правильное, а аккумулятор сильно выделяет газ или кипит.
- Плохая производительность при запуске или низкая мощность в ампер-часах.
- Когда SoC, измеренный ареометром, который является более точным, существенно не согласуется с SoC, измеренным цифровым вольтметром
[назад к указателю]
16.2. Как предотвратить перманентную сульфатацию?
Лучший способ предотвратить сульфатирование — держать свинцово-кислотную батарею полностью заряженной, поскольку сульфат свинца не образуется. Это можно сделать тремя способами. В зависимости от типа батареи, которую вы используете, лучшим решением является использование внешнего зарядного устройства в хорошо вентилируемом помещении, которое способно обеспечить непрерывный «плавающий» заряд с температурной компенсацией при рекомендованном производителем аккумуляторе плавающем или поддерживающем напряжении для полностью заряженного. аккумулятор. Для 12-вольтных батарей, в зависимости от типа батареи, обычно фиксированные значения напряжения холостого хода от 13,1 до 13,9 В постоянного тока, измеренные при 77 ° F (25 ° C) с помощью точного (0,5% или выше) цифрового вольтметра. Для шестивольтовой батареи измеренное напряжение составляет половину от напряжения 12-вольтовой батареи. Это может быть лучше всего достигнуто путем непрерывной зарядки с использованием трехступенчатой для аккумуляторов AGM (Ca / Ca) или гелевых (Ca / Ca) VRLA или четырехступенчатой для залитых (влажных) аккумуляторов, «интеллектуального» зарядного устройства с микропроцессорным управлением.
Это можно сделать тремя способами. В зависимости от типа батареи, которую вы используете, лучшим решением является использование внешнего зарядного устройства в хорошо вентилируемом помещении, которое способно обеспечить непрерывный «плавающий» заряд с температурной компенсацией при рекомендованном производителем аккумуляторе плавающем или поддерживающем напряжении для полностью заряженного. аккумулятор. Для 12-вольтных батарей, в зависимости от типа батареи, обычно фиксированные значения напряжения холостого хода от 13,1 до 13,9 В постоянного тока, измеренные при 77 ° F (25 ° C) с помощью точного (0,5% или выше) цифрового вольтметра. Для шестивольтовой батареи измеренное напряжение составляет половину от напряжения 12-вольтовой батареи. Это может быть лучше всего достигнуто путем непрерывной зарядки с использованием трехступенчатой для аккумуляторов AGM (Ca / Ca) или гелевых (Ca / Ca) VRLA или четырехступенчатой для залитых (влажных) аккумуляторов, «интеллектуального» зарядного устройства с микропроцессорным управлением. Если у вас уже есть двухступенчатое зарядное устройство, используйте стабилизируемое по напряжению «плавающее» зарядное устройство или «вспомогательное устройство» аккумулятора, установите правильное поддерживающее напряжение с температурной компенсацией на «плавающее» или поддерживайте полностью заряженный аккумулятор. Если вам нужны веб-адреса или номера телефонов производителей зарядных устройств, см. Разделы «Зарядные устройства, плавающие зарядные устройства и специалисты по обслуживанию аккумуляторов» в списке ссылок с информацией об аккумуляторах . Дешевая нерегулируемая «струйка» или ручное двухступенчатое зарядное устройство может перезарядить батарею и разрушить ее, высушив электролит.
Если у вас уже есть двухступенчатое зарядное устройство, используйте стабилизируемое по напряжению «плавающее» зарядное устройство или «вспомогательное устройство» аккумулятора, установите правильное поддерживающее напряжение с температурной компенсацией на «плавающее» или поддерживайте полностью заряженный аккумулятор. Если вам нужны веб-адреса или номера телефонов производителей зарядных устройств, см. Разделы «Зарядные устройства, плавающие зарядные устройства и специалисты по обслуживанию аккумуляторов» в списке ссылок с информацией об аккумуляторах . Дешевая нерегулируемая «струйка» или ручное двухступенчатое зарядное устройство может перезарядить батарею и разрушить ее, высушив электролит.
Второй метод — периодическая подзарядка (или «дозаправка») батареи, когда уровень заряда падает до 80% или ниже. Поддержание высокого уровня заряда предотвращает необратимую перманентную сульфатацию. Частота подзарядки зависит от паразитной нагрузки, температуры, состояния аккумулятора и типа аккумулятора. Более низкие температуры замедляют электрохимические реакции, а более высокие температуры их значительно усиливают. Аккумулятор, хранящийся при температуре 95 ° F (35 ° C), саморазрядится в два раза быстрее, чем аккумулятор, хранящийся при температуре 77 ° F (25 ° C).Стандартные (Sb / Sb) батареи имеют очень высокую скорость саморазряда. Аккумуляторы AGM (Ca / Ca) и гелевые (Ca / Ca) VRLA имеют очень низкие показатели. Дополнительную информацию о типах батарей см. В разделе 7.1.
Более низкие температуры замедляют электрохимические реакции, а более высокие температуры их значительно усиливают. Аккумулятор, хранящийся при температуре 95 ° F (35 ° C), саморазрядится в два раза быстрее, чем аккумулятор, хранящийся при температуре 77 ° F (25 ° C).Стандартные (Sb / Sb) батареи имеют очень высокую скорость саморазряда. Аккумуляторы AGM (Ca / Ca) и гелевые (Ca / Ca) VRLA имеют очень низкие показатели. Дополнительную информацию о типах батарей см. В разделе 7.1.
Существует компромисс между экономичностью непрерывной «плавающей» зарядки, при которой саморазряд и возникающее в результате сульфатирование не происходит, и периодической зарядкой с увеличенным потенциалом для более короткого срока службы батареи из-за постоянного сульфатирования. Если вы решите периодически перезаряжать батареи во время хранения, увеличивая частоту перезарядки, отключая любую паразитную нагрузку или храня их при более низких температурах, это затруднит саморазряд и снизит вероятность постоянного сульфатирования, но также сократит общий срок службы циклы.
Третий метод — использование солнечной панели, ветряного или водяного генератора, предназначенных для «плавающей» зарядки аккумуляторов. Это популярное решение, когда для зарядки нет источника переменного тока. Размер необходимой солнечной панели, ветра или водогенератора будет зависеть от среднего количества доступных природных ресурсов, емкости батареи и температуры. Обычно для среднего автомобильного аккумулятора требуется минимум пять ваттных панелей. Контроллер заряда (регулятор напряжения) требуется, когда пиковый выходной ток превышает 1.5% от номинальной емкости аккумулятора в ампер-часах (C / 20).
Десульфатор можно использовать в сочетании с любым из вышеуказанных методов.
[вернуться к оглавлению]
16.3. Как восстановить сульфатированные батареи?
Вот несколько методов, чтобы попытаться восстановить постоянно сульфатированные батареи:
16.3.1. Легкая сульфация
Проверьте уровень электролита и попробуйте один из следующих трех методов удаления легкого сульфатирования:
16. 3.1.1. Выровняйте аккумулятор. См. Раздел 9.1.4. для получения дополнительной информации о выравнивании.
3.1.1. Выровняйте аккумулятор. См. Раздел 9.1.4. для получения дополнительной информации о выравнивании.
16.3.1.2. Подайте постоянный ток при 0,6% от резервной емкости аккумулятора или 1% от номинальной емкости ампер-часов (C / 20) в течение 48–120 часов, в зависимости от температуры электролита и емкости аккумулятора, при 14,4 В постоянного тока или более, в зависимости от от типа аккумулятора. Например, если батарея имеет номинал RC 100 минут или 60 ампер-часов (C / 20), используйте приблизительно 0,6 ампера. Выполните цикл (разрядка до 50% и зарядка) аккумулятора несколько раз и повторно проверьте его емкость. Возможно, вам придется увеличить напряжение, чтобы разрушить твердые кристаллы сульфата свинца. Если температура аккумулятора превышает 125 ° F (51,7 ° C), прекратите зарядку и дайте аккумулятору остыть , прежде чем продолжить.
16.3.1.3. Используйте десульфатор, импульсное зарядное устройство или режим десульфатации зарядного устройства. Список некоторых производителей десульфаторов или импульсных зарядных устройств доступен в Списке ссылок на батареи по адресу http: // www.batteryfaq.org.
16.3.2. Тяжелый сульфатион
Проверьте уровни электролита и попробуйте один из следующих двух методов удаления тяжелого сульфата:
16.3.2.1. Замените старый электролит дистиллированной, деионизированной или деминерализованной водой, дайте постоять в течение одного часа, подайте постоянный ток в четыре ампера при 13,8 В постоянного тока до тех пор, пока не перестанет расти удельный вес, удалите электролит, промойте осадок, замените свежим электролит (аккумуляторная кислота) и зарядите.Если удельный вес превышает 1,300, удалите новый электролит, промойте осадок и начните сначала с дистиллированной водой. Возможно, вам придется увеличить напряжение, чтобы разрушить твердые кристаллы сульфата свинца. Если температура аккумулятора превышает 125 ° F (51,7 ° C), прекратите зарядку и дайте аккумулятору остыть, прежде чем продолжить. Выполните цикл (разрядите до 50% и зарядите) аккумулятор несколько раз и повторно проверьте его емкость. Кристаллы сульфата более растворимы в воде, чем в электролите.По мере растворения этих кристаллов сульфат снова превращается в серную кислоту, и удельный вес увеличивается. Эта процедура работает только с некоторыми батареями.
16.3.2.2. Используйте десульфатор, импульсное зарядное устройство или режим десульфатации зарядного устройства. Список некоторых производителей десульфаторов или импульсных зарядных устройств доступен в Списке ссылок на батареи на http://www.batteryfaq.org.
[вернуться к оглавлению]
16.4. Где я могу найти дополнительную информацию о сульфатировании?
Принципиальная схема десульфатора импульсного типа может быть найдена в этой статье, представленной Alistair Couper для десульфатора свинцово-кислотных аккумуляторов .
<<< Предыдущая [Главная] [Верхний] Далее >>>
Лучшие советы по продлению срока службы аккумулятора вашего ноутбука
Современные ноутбуки мощнее, чем когда-либо прежде, а благодаря достижениям в области мобильных технологий они также стали более эффективными, что увеличивает время автономной работы.
Тем не менее, их все равно нужно включать в сеть в течение дня. Несмотря на то, что время автономной работы ноутбука является основной причиной мобильных жалоб, можно добиться значительных улучшений с помощью хорошей практики и нескольких программных настроек.Вот 10 простых способов улучшить время автономной работы ноутбука.
Подробнее: ScreenFlow 8
1. Уменьшите яркость экрана
Экран — одна из самых энергоемких частей ноутбука. Чтобы дисплей оставался четким и ярким, требуется очень много заряда аккумулятора. Чтобы сэкономить эту мощность, нужно просто уменьшить яркость.
Кнопка яркости экрана обычно расположена как вторая функция одной из клавиш F и представлена маленьким символом солнца с иконками вверх и вниз.Чтобы использовать его, просто нажмите и удерживайте соответствующую функциональную клавишу, а затем выберите «вверх» или «вниз».
2. Измените параметры питания
Windows 10 имеет несколько отличных функций питания, которые позволяют добиться максимальной производительности, когда вы подключены к сети, и оптимизировать время автономной работы в пути.
Введите «параметры питания» в поле «Начать поиск» и выберите из списка «Энергосбережение». В Windows 10 также есть больше способов сэкономить заряд батареи. К ним относятся настройки для выключения монитора и более быстрого перехода в спящий режим.
3. Отключите Wi-Fi
Одним из самых важных факторов, способных разгрузить аккумулятор, являются возможности беспроводной сети, встроенные в большинство ноутбуков. Wi-Fi разряжает аккумулятор, постоянно потребляя энергию от аккумулятора и, когда он не подключен, ищет сети.
Когда вы используете свой ноутбук вдали от сети, велика вероятность, что вы находитесь вдали от беспроводных сетей, поэтому вы можете выключить это устройство. На многих ноутбуках есть функциональная кнопка, с помощью которой можно вручную выключить беспроводной адаптер, чтобы сэкономить ненужные отходы, но в старых ноутбуках этого часто нет.
В этом случае откройте Центр уведомлений, щелкнув значок пузыря речи в правой части панели задач, и нажмите «Wi-Fi», чтобы выключить его.
4. Выключите периферийные устройства
Использование периферийных устройств USB может истощить вашу систему, потому что ваша материнская плата должна их запитать, поэтому отключение всего от сети экономит энергию. USB-накопители, мыши и веб-камеры — частые нарушители, поэтому скопируйте всю свою информацию и извлеките свои устройства как можно скорее, и смиритесь с трекпадами ноутбука поверх USB-мыши.
Многие ноутбуки имеют функциональные кнопки для выключения встроенной веб-камеры, которая разряжает аккумулятор, если есть такая возможность. И переключите динамики на отключение звука, если вам не нужен звук — ваш ноутбук пищит каждый раз, когда он получает электронное письмо или загружает Windows, может быть утечкой.
5. Извлеките дисководы
Вращение диска в дисководе — огромная трата ресурсов, и многие программы постоянно это делают. Просто извлеките диски перед тем, как переключиться на питание от аккумулятора, чтобы сэкономить жизненно важные дополнительные минуты рабочего дня.
В наши дни в большинстве современных ноутбуков нет дисководов, но если у вас есть дисковод, стоит убедиться, что он пустой, когда вы в пути.
6. Инвестируйте в оборудование
Хорошая практика может в некоторой степени продлить срок службы батареи, но если вам нужно использовать ноутбук в течение рабочего дня, вам понадобится помощь.
Большинство ноутбуков поставляются с шестиячеечной батареей, но многие производители предлагают дополнительные обновления на восемь или даже 12 элементов, которые могут удвоить вашу мощность.
Альтернативой дорогим аккумуляторам для ноутбуков являются портативные зарядные устройства для ноутбуков, которые дают вам дополнительные часы работы для всех ваших устройств. Обычно это компактные аккумуляторные блоки, у которых есть адаптеры для большинства ноутбуков и мобильных телефонов, которые достаточно портативны, чтобы их можно было положить в сумку, и имеют достаточную емкость, чтобы удвоить продолжительность вашего заряда.
Ознакомьтесь с нашим списком лучших портативных зарядных устройств и аккумуляторов для портативных компьютеров, чтобы найти лучшие устройства для зарядки вашего ноутбука.
7. Отключение функций
Windows 10 имеет несколько удобных встроенных функций, но многие из них предъявляют к вашей системе требования, которые не нужны при работе в дороге. Просто отключите графические эффекты, когда вы в пути, чтобы сделать свой ноутбук более эффективным.
8. Уход за батареей
Литий-ионные батареи не нуждаются в полной разрядке (вопреки распространенному мнению), но вам также следует использовать батарею после ее зарядки.
Если у вас есть запасной, который вы постоянно пополняете, используйте его вместо основного.Если у вас старая не литий-ионная батарея, вам необходимо регулярно ее разряжать.
Вот как расположить элементы для получения аккумуляторной батареи.
Большинство строителей гаражей, которые решают собрать свой собственный аккумулятор, обычно имеют большой опыт. Тем не менее, сборка пакетов по-прежнему является частым источником вопросов от новичков, поэтому я решил составить статью, чтобы охватить основы.
Ячейки параллельно, P-счетчик
[В этой статье я буду использовать небольшой прямоугольный пакет в качестве примера, это самый простой стиль для понимания при изучении этих принципов.Как только вы это усвоите, вы сможете легко масштабировать свою упаковку до различных форм и размеров]
Если вы возьмете несколько ячеек и соедините их электроды одного типа по параллельно , все они будут вести себя как , как если бы они были одной большой ячейкой . Кроме того, когда вы впервые подключаете их друг к другу, они ДОЛЖНЫ иметь одинаковый уровень заряда [положительный электрод — это катод, а отрицательный электрод — это анод. На рисунках ниже положительный знак — красный знак плюс, отрицательный — черная черта].
Под этим я подразумеваю … если вы подключите полностью заряженный элемент «параллельно» к элементу с низким уровнем заряда, высокий элемент попытается зарядить низкий элемент всего за несколько секунд, поскольку между ними нет встроенного сопротивления. их через соединяющий автобус, чтобы замедлить работу. При быстром выравнивании они оба станут ОЧЕНЬ горячими. Необратимые повреждения — это наименьшее из возможных повреждений, и, скорее всего, один из них (или оба) загорится. Однако, если разница между ними составляет всего одну десятую вольта, это не будет проблемой (например, от 4.От 1 до 4,2 В будет нормально, они оба уравняют при 4,15 В).
Четыре параллельных элемента в пакете 7S / 4P (28 ячеек). Сверху и снизу этих четырех ячеек имеется полноразмерная электрически соединяющая металлическая полоса (шина). Четыре параллельных ячейки могут иметь любую форму, но их прямая линия — самое простое введение в понимание этого.
P-счетчик определяет емкость батареи в ампер-часах (Ач), а также определяет количество тока , которое может произвести батарея, измеренное в амперах.В этом примере мы будем использовать мой любимый аккумулятор для электровелосипеда, Samsung 30Q. По заводским настройкам он имеет емкость 3000 мАч (миллиампер-час), что соответствует 3-ампер-часам (3-Ач). Если у вас есть четыре параллельно, готовая батарея может быть оценена как диапазон 12-Ач (4P X 3-Ач = 12-Ач).
Теперь мы подошли к количеству мощности, которую батарея может безопасно выдать. 30Q — это элемент с горячим стержнем (наряду с HG2 и 25R), и он рассчитан на заводе на постоянную мощность 15 А. Тем не менее, почти все модели ячеек нагреваются, если вы действительно используете их непрерывно с указанным рейтингом.Я рекомендую никому не допускать, чтобы их рюкзак нагрелся выше 140F (60C) ни при каких условиях. Это приведет к очень короткому сроку службы упаковки.
К счастью, электровелосипеды обычно потребляют пиковый ток только в течение нескольких секунд при ускорении. Как только вы достигнете крейсерской фазы, постоянный ток, потребляемый контроллером и двигателем, будет НАМНОГО ниже, когда вы просто поддерживаете свою скорость. Если мы будем использовать значение 15А в качестве максимального значения, рассчитанного нами, батарея немного нагреется, а это значит, что она прослужит очень долго. Четыре параллельно подключенных элемента 30Q, рассчитанные на 15 А, означают, что мы можем рассчитывать на получение 60 А из этого блока без повреждений (4P X 15A = 60A).
Ячейки последовательно, количество S
Когда вы соединяете элементы вместе в серии , это не меняет ни ампер, ни емкость, а только повышает напряжение батареи. Соединение их последовательно означает, что вы подключаете положительный конец одной ячейки (или P-группы) к отрицательному концу другой.
Для наиболее популярных цилиндрических элементов формата 18650 (диаметр 18 мм, длина 65 мм) используется химия лития-NCA или лития-NCM (в катоде используется никель-кобальт-алюминий… или… никель-кобальт-марганец. ). Эти химические элементы имеют номинальное (среднее) напряжение 3,7 В … и для того, чтобы получить максимально возможный срок службы батареи, используйте 3,3 В на последовательный элемент в качестве отсечки низкого напряжения (LVC) и 4,1 В как полностью -заряженная мишень.
Семь последовательно соединенных ячеек в блоке 7S / 4P, номинальное напряжение 24 В.Это 28,7 В при полной зарядке до 4,1 В на элемент.
Обычно максимальный заряд составляет 4,2 В на элемент, но когда элементы находятся в состоянии покоя (в течение любого периода времени) при таком высоком напряжении, это значительно сокращает их срок службы. Зарядите батарею до 4,1 В , умножив на серийный номер.
BMS, как подключить?
BMS — это система управления батареями. Он выполняет несколько функций. Два толстых провода (красный и черный) от зарядного устройства будут «заряжать» аккумулятор до тех пор, пока он не приблизится к полному, а затем зарядное устройство переключится на использование очень низкой скорости зарядки по мере приближения к полному.Уровень заряда 3А или 5А (непрерывный) очень распространен для объемного заряда.
Этот профиль зарядки называется CC / CV, для постоянного тока / постоянного напряжения. Это простой и недорогой способ достичь тонкой цели.
Нам всем нужен доступный аккумулятор, поэтому… мы покупаем элементы массового производства. Это означает, что всегда будут очень незначительные различия во внутреннем сопротивлении каждой ячейки. Чтобы использовать приведенный выше пример нашего теоретического блока 7S / 4P… каждая группа ячеек 4P «воспринимается» зарядным устройством и контроллером как одна большая ячейка.Параллельно соединяющая металлическая полоса гарантирует, что все они постоянно уравновешиваются друг с другом, поэтому мы должны обсуждать их, как если бы они были фактически одной большой ячейкой.
Есть семь таких «последовательно», чтобы получить 24 В. Затем мы устанавливаем наш основной источник постоянного тока в качестве зарядного устройства на 3 А (без BMS) и используем (7S X 4,1 В =) 28,7 В в качестве нашей полностью заряженной цели. Это работает как мечта. Однако на самом деле только пять из P-групп имеют напряжение 4,1 В. Одна P-группа имеет 3,9 В из-за высокого внутреннего сопротивления, а другая P-группа — 4.3В из-за низкого внутреннего сопротивления. Поскольку наше глупое зарядное устройство считывает только 28,7 В собранной батареи, когда оно отключается, оно не имеет представления о назревающей проблеме…
Ячейки с высоким сопротивлениемнагреваются сильнее, чем ячейки со «средним сопротивлением», но для этого обсуждения давайте просто предположим, что они никогда не становятся «слишком горячими», чтобы вызвать проблемы (более 140F / 60C). К тому же… ячейки, расположенные в центре упаковки, нагреваются сильнее, чем ячейки на краю, так как ячейки, расположенные на краях, отдают «некоторое» тепло внешней оболочке упаковки.
Остается рассмотреть элемент с низким сопротивлением. Он будет сбрасывать токи быстрее, чем другие элементы (при ускорении), а также быстрее глотать заряд. На самом деле он будет работать холоднее, чем другие элементы со «средним сопротивлением», но … зарядное устройство для большой емкости перезарядит его. Если позволить батарее оставаться на ночь при 4,2 В на ячейку, сократит ее срок службы вдвое (по сравнению с 4,1 В на ячейку), тогда … что даст возможность одной ячейке оставаться на ночь при 4,3 В? Он быстро потеряет емкость.
И это означает, что одна неисправная ячейка вызовет падение напряжения во всей Р-группе ближе к концу поездки, а затем … эта одна низкая Р-группа вызовет падение напряжения во всей батарее.А это означает, что… на долю секунды при ускорении LVC «подумает», что весь пакет слишком мал, и отключит ВСЕ питание, чтобы «спасти» пакет (одна из его самых важных задач).
Пакет по-прежнему будет «работать», но… дни ускорения прошли. Возможно, вы планировали купить новый пакет через три года (или более), но из-за одной «немного» плохой ячейки весь пакет теперь бесполезен для вас всего через несколько месяцев. Вот почему в фазе объемного заряда (CC / постоянный ток) батарея разряжается примерно до 4 единиц.0 В на ячейку. Для остальной части подзарядки фаза постоянного напряжения / CV достигается при низких значениях тока с добавлением некоторых чувствительных электронных компонентов…
Жгут BMS. 14 проводов указывают на то, что это сделано для блока 13S, что составляет 48 В. Обратите внимание, что один провод черный (или, по крайней мере, другого цвета, чем остальные). Некоторые жгуты BMS имеют разный цвет для каждой P-группы, но… это действительно будет работать нормально, если вы будете следовать общему шаблону.
В BMS есть одна безумная «электроника вуду».Количество малых балансировочных проводов будет… «порядковый номер плюс один». Итак, в нашем теоретическом пакете 7S будет восемь балансировочных проводов. Это звучит просто безумно. Каждый, кто начинает изучать батареи, ЗНАЕТ, что есть два полюса (для каждой ячейки или P-группы). Красный положительный и черный отрицательный. Вы могли бы подумать, что для балансировки заряда при низких амперах во время последней фазы CV заряда … вам понадобится 14 проводов вместо восьми, когда вы вносите незначительные изменения в семь P-групп (помните, что каждая P-группа будет действовать как одна большая ячейка).
Базовая схема подключения BMS для блока 7S. Как только вы поймете шаблон, вы можете расширить его до любого размера упаковки.
Посмотрите внимательно на картинку выше. Белый штекер подключает тупой жгут к интеллектуальной BMS. Вы можете видеть, что для BMS, чтобы получить доступ к положительному и отрицательному концам первой ячейки (и подключенной первой P-группы), она использует провода номер 1 и номер 2. Однако при перемещении по второй ячейке?… BMS использует провода №2 и №3. Провод номер два иногда используется как положительный к ячейке с номером 1, а иногда используется как отрицательный к ячейке с номером 2 (и «так далее» вниз по строке, пока вы не дойдете до всех P -группы в строке серии).
Это устраняет 45% возможных жгутов проводов BMS, но .. это также затрудняет правильное расположение соединений для начинающих строителей. Даже если вы все еще немного запутались, просто внимательно следуйте инструкциям BMS.
Боковое примечание: Если ваш аккумулятор внезапно умирает без очевидной причины, обычно это происходит из-за отказа какого-либо компонента в BMS, что приводит к полному разряду аккумулятора до нуля или … большому перезаряду выше 4,2 В. Вот почему их иногда называют подозреваемыми в убийстве батареи .
Другие варианты химии?
Стандартный химический состав NCA / NCM обеспечивает лучший баланс между емкостью в небольшом корпусе и полезным количеством ампер. Однако есть и другие химические составы, которые могут быть вариантом для определенных приложений. «Номинальное» напряжение NCA / NCM широко считается равным 3,7 В, на элемент и… для максимально возможного срока службы , я бы использовал 3,3 В, на элемент в качестве LVC и 4.1V как полная зарядка.
LiFePO4 / LFP обычно называют «фосфатом железа», и он имеет номинальное напряжение 3,2 В, на элемент. Это означает, что для изготовления блока 48 В и требуется 16 элементов LiFePO4, а для NCA / NCM требуется только 13 элементов для 48 В. Тем не менее, LiFePO4 считается наиболее пожаробезопасным (иногда используется в качестве стартерной батареи на небольших самолетах), и они также обычно служат примерно в два раза дольше, чем обычные блоки 18650-ячеек NCA / NCM.
Комплект LFP 4S является наиболее распространенной заменой свинцово-кислотного аккумулятора 12 В (4 полюса X 3,2 В = номинальное напряжение 12,8 В).
При этом NCA / NCM в ячейках формата 18650 имеют гораздо лучший выбор и обеспечивают высокую мощность и большую дальность действия в небольшом корпусе, который доступен по цене благодаря массовому производству. LFP можно найти в плоских ячейках-мешках, 26650 (26 мм X 65 мм) и больших цилиндрических ячейках 38120 (огромных! 38 мм X 120 мм, от Headway, см. Ниже). Я действительно нашел LiFePO4 в формате 18650, но… емкость была ОЧЕНЬ низкой.
ЯчейкиHeadway LFP имеют резьбовые концы, что упрощает сборку в пакет. Однако самая маленькая из них размером примерно с два одноразовых D-элемента.
Еще один малоизвестный химический состав — литий-титанат-оксид ( LTO ). Он имеет еще более низкое номинальное напряжение 2,4 В, на элемент. Он может прослужить в десять раз дольше, чем NCA / NCM, и он также хорошо работает в очень холодную погоду (наряду с обеспечением высокого тока). Однако я нашел их только в плоских ячейках-мешочках, их трудно найти, они дороги и имеют несколько вариантов размера.
Химические вещества NCA / NCM также можно найти в немного более крупных цилиндрических ячейках формата 21700. Они были разработаны Panasonic в партнерстве с электромобилями Tesla. Однако в настоящее время они дороги, и большая часть заводского производства идет на Tesla Model-3, а также на силовые экраны (домашнюю систему резервного питания).
Вот четыре плоских ячейки пакета LFP, последовательно соединенные (4S). В то время как ячейки формата 18650 имеют вокруг себя стальной цилиндр, обеспечивающий сжатие и физическую защиту, ячейки мешка должны быть добавлены при сборке упаковки.(обратите внимание, что жгут BMS имеет четыре черных провода и один красный). 3,2 В X 4S = номинальное значение 12,8 В для замены свинцово-кислотной батареи на 12 В.
Варианты ЕСТЬ, но … после любого глубокого исследования почти каждый ebiker возвращается к ячейкам формата 18650 в химии NCA или NCM.
Соты сладкие
В приведенном выше примере пакета (7S / 4P) ячейки выровнены в прямые строки и столбцы, которые я мог бы назвать «рядовыми» (как марширующие солдаты).Однако следующая по популярности компоновка состоит в том, чтобы вкладывать ячейки одного ряда в впадины следующего, что многие стали называть… сотовой компоновкой. Мне это нравится, но у каждого варианта есть свои преимущества и недостатки.
Вот пластиковые заглушки, которые помогают разместить ячейки в сотовой структуре.
Использование сотовой компоновки — математически наиболее компактный способ расположения ячеек. При этом обычная система рядовых элементов оставляет «ровно достаточно» пространства между четырьмя соседними ячейками, чтобы позволить тонкому болту пройти от одной боковой пластины к другой (как показано ниже), а соты нет.
Пластиковые держатели ячеек на торцевых крышках являются важным элементом безопасности для упаковки, сделанной своими руками. При обычном квадратном макете ячейки обычно располагаются так, чтобы они почти касались друг друга. Это означает, что циркуляции воздуха почти не будет, и это приводит к тому, что клетки в центре рюкзака постепенно нагреваются к концу поездки.
Если у вас достаточно большой аккумулятор, и элементы могут обеспечивать большой ток, тогда… слаботочная поездка даже не согреет их. На другом конце шкалы небольшой пакет слаботочных элементов, которые забивают во время поездки, определенно нагревается.Самым горячим местом всегда будут положительные катодные наконечники на элементах в центре пакета.
Пластиковые монтажные колпачки 18650 от Ann Power. Латунные вставки с резьбой полностью открыты. Болты для крепления обоих концов вместе можно заказать из пластика, если стандартная сталь болта вызывает беспокойство.
На рисунке ниже вы можете видеть, что при использовании сотовой структуры боковой угол уложенных друг на друга ячеек составляет примерно 30 градусов от углов в 90 градусов в обычной прямоугольной упаковке.Это делает его естественным вписывающимся в нижнюю часть пространства треугольника рамки. Лучше всего разместить рюкзак по центру рамы, чтобы его можно было разместить, чтобы велосипед хорошо управлялся.
Это изображение взято с российского веб-сайта, посвященного дизайну аккумуляторных батарей, и оно помогает вам определить, сколько ячеек поместится в вашем корпусе.
Российскую программу-конфигуратор аккумуляторных батарей можно найти здесь. Не стесняйтесь экспериментировать со всеми возможными настройками, чтобы увидеть, что делают окна настроек.
Пачки треугольников и нестандартные формы
Самая простая в изготовлении упаковка — это прямоугольник (как показано выше). Однако, как на картинке ниже, иногда полезно сделать рюкзак треугольником или другой необычной формой. На приведенном ниже рисунке конструктор пытается выполнить «сухую» подгонку, чтобы увидеть, как будут работать показанные 100 ячеек, а также как организовать параллельные группы 5P, которые теперь находятся в кластерах нечетной формы (вместо того, чтобы быть встроенными).
Так выглядят 100 ячеек в формате 18650 в треугольнике рамы велосипеда.Этот конкретный пакет будет 20S / 5P.
Вместо использования никелевой ленты для последовательного и параллельного подключения вы можете использовать плоскую пластину для выполнения всех функций электрической шины. Эта батарея 21S имеет группы 12P для ОГРОМНОЙ упаковки из 252 ячеек…
Показанный выше огромный аккумуляторный блок от Mark’s Cromotor Phatrod, который можно найти, нажав здесь.
Какое напряжение выбрать?
Фактические точные напряжения являются приблизительными, но … вот наиболее распространенные значения серийного счета 18650 ячеек и номинальные напряжения.
24В… 7S _____________ 52В… 14S
36В… 10С ____________ 60В… 16С
44В… 12С ____________ 72В… 20С
48V… 13S ____________ 88V… 24S (100V при полной зарядке)
Для больших ампер и хорошего диапазона мне нравится 30Q, который обеспечивает 3000 мАч, и 15A . Если вам нужен 20A на ячейку, обратите внимание на Sony VTC6, LG HG2 и Samsung 25R
.Если ваша батарея достаточно велика, и вам не нужны высокие усилители 30Q, вы можете получить больший диапазон, выбрав одну из популярных ячеек 10A , которые обычно рассчитаны на около 3400 мАч.Три примера — Samsung 35E, LG MJ1, Panasonic GA (через несколько месяцев после публикации любой статьи может появиться еще больше вариантов для сравнения, поэтому сделайте домашнюю работу перед покупкой)
Мне нравятся 48В и 52В по разным причинам. Если вы перешли на более высокое напряжение, потребовалось бы добавить больше параллельных групп в последовательную цепочку, чтобы поднять напряжение. Легко было бы быстро получить большой, тяжелый и дорогой дизайн. Несколько лет назад было мало вариантов, когда дело дошло до того, сколько ампер могут выдавать элементы 18650, поэтому единственным вариантом для высокой производительности было высокое напряжение.
При этом … чем больше вольт вы используете, тем меньше ампер вам нужно будет вытащить из аккумулятора, чтобы получить производительность, необходимую для вашей дроссельной заслонки.
Теперь… есть ячейки формата 18650, которые могут выдавать 20 А, но они дорогие, а 30Q популярен не зря. Он может выдавать 15 А, поэтому относительно небольшой блок 4P может выдавать 60 А. Блок 13S / 48V, использующий 4P, будет состоять всего из 52 ячеек и будет иметь диапазон 12 Ач. Эффективные системы среднего привода могут развивать скорость до 2 миль на Ач, поэтому 12-Ач может обеспечить дальность действия более 24 миль.
Что касается напряжения ниже 48 В / 52 В, то если вы живете там, где оно довольно ровное, вы можете получить приемлемую производительность от 36 В (10S). Пакет 4P из 10S всего 40 ячеек! (очень легко помещается). Конечно, даже если вам не нужно много вольт или много энергии, если у вас есть бюджет и место в раме для установки батареи большего размера, тогда аккумулятор будет работать меньше. Если охладить батарею, она прослужит как можно дольше.
И последнее замечание: аккумулятор для электронного велосипеда — один из самых больших аккумуляторных блоков, которые вы, вероятно, когда-либо купите в своей жизни.Если вы можете достичь своих целей с помощью блока питания на 48 В или 52 В, любой из них может запитать инвертор в случае бедствия, чтобы обеспечить дом 120 В переменного тока. Если вы используете 4P обычных ячеек на 10 А (40 А), а батарея на 52 В, то… 40 А X 52 В = 2100 Вт. Этой мощности достаточно, чтобы надолго проработать холодильник и телевизор. И чем больше упаковка, тем дольше может работать ваша техника…
Зачем столько хлопот?
На картинке ниже член ES Кеплер построил крошечный пакет 14S / 4P (52 ячейки), который идеально подходит для его любимой рамы электровелосипеда, в которой используется средний привод Bafang BBS02.В интересах полного раскрытия информации, в моем любимом электровелосипеде используется большой пакет на 52 В, который я купил в Luna Cycle.
Kepler’s «Super Commuter» с самодельной аккумуляторной батареей из 18650 элементов.
Часть-2
После того, как вы определились с напряжением, размером и формой, я расскажу о многих вещах в части 2 (нажмите здесь), и среди них есть все популярные методы соединения ячеек друг с другом, такие как точечная сварка и сварка проволокой (добавьте ссылку на часть 2 здесь)…
Если вам понравилась эта статья, вам также может понравиться…
«Что внутри ячейки 18650 и почему это важно»
«BMS, что, черт возьми, они делают?»
«Аккумулятор для электромобилей домашнего производства из 18650 ячеек»
Присылайте предложения, исправления и угрозы смертью: Заключенному № 41, исправительное учреждение штата Канзас для душевнобольных преступников.
Написано Роном / spinningmagnets, февраль 2019
.




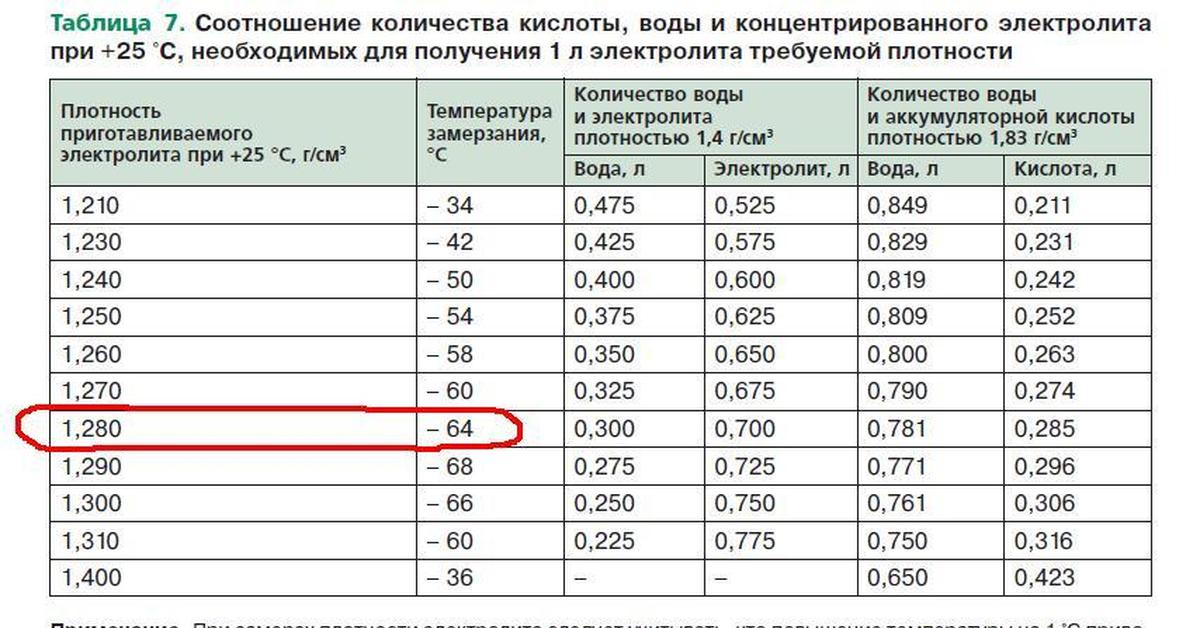
 Повышенное потребление воды также может указывать на наличие сульфатирования.
Повышенное потребление воды также может указывать на наличие сульфатирования.